作为专注肿瘤精准医疗领域的国家高新技术企业,求臻医学拥有一套成熟的线下线上患者招募体系,涵盖了完善的内部管理制度、标准化招募流程,能够快速并准确的筛选符合药企临床实验的目标患者,全程仅需1~2周。目前EGFR 20号外显子插入突变的局部晚期或转移性非小细胞肺癌患者正在招募中。


项目介绍

试验题目:“评价JMT101联合奥希替尼治疗携带EGFR 20号外显子插入突变的局部晚期或转移性非小细胞肺癌患者的有效性和安全性的Ⅱ期临床研究”
试验目的:评价JMT101联合奥希替尼治疗既往至少接受过含铂化疗的携带EGFR 20号外显子插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)患者的有效性和安全性
试验分期:该研究现已进入Ⅱ期临床试验(国家食品药品监督管理局的批准,批件号CTR20212469)
适应症:携带EGFR 20号外显子插入突变的ⅢB ~ Ⅳ期非小细胞肺癌
JMT101药物:是由上海津曼特生物科技有限公司自主研发的抗EGFR人源化单克隆抗体,与EGFR靶点的亲和力分别约为同类药西妥昔单抗和帕尼单抗的7倍和2倍。JMT101通过与EGFR结合,阻断细胞内信号转导途径,从而抑制癌细胞的增殖,诱导癌细胞的凋亡。
招募人数:面向社会公开招募患者155例


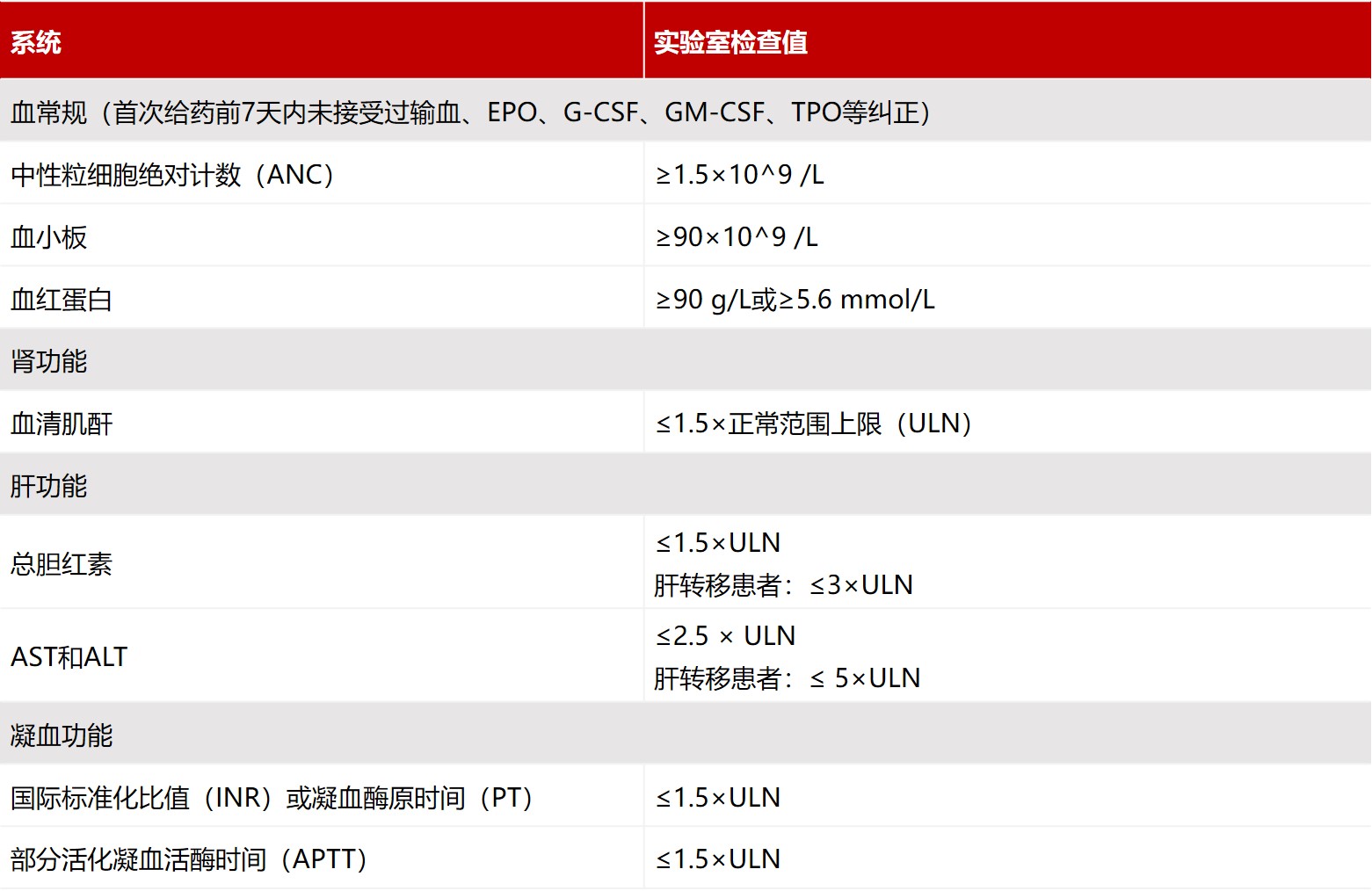
入选标准



排除标准



相关信息

启动时间:2021年11月
组长单位:中山大学肿瘤防治中心
主要研究者:张力 教授
申办方:上海津曼特生物科技有限公司
参研中心:

* 项目查询:国家食品药品监督管理总局药品审评中心临床试验登记与信息公示平台http://www.chinadrugtrials.org.cn,如您身边有合适的患者意向入组,请联系求臻医学药企合作部:张先生 15011165799
求臻医学药企合作服务
求臻医学专注肿瘤多基因检测,以新一代基因测序和先进信息挖掘技术为基础,为药企提供专业化解决方案。现已与国内外10余家药企就科研/学术合作、临床试验检测、伴随诊断、患者招募、多组学人工智能ChosenMIP大数据服务等展开深入合作,通过将基因检测和人工智能技术深度应用于真实世界研究项目,不断探索发现中国人肿瘤基线及特异的生物标志物,助力抗肿瘤药物的研发,为药企临床前研究、转化医学研究、临床开发和诊断产品开发提供全流程的专业服务。目前,求臻医学构建了遍布全国范围的营销网络,服务于国内500余家顶级医疗机构,为肿瘤患者提供精准诊疗一体化检测服务/为患者提供精准的肿瘤基因检测服务。