臻知识·专家访谈 | 第25期

近年来,液体活检作为一种新兴的无创检测技术,在肿瘤疗效监测,耐药探索及复发风险评估等方面的应用日趋普遍。既往已有研究探索液体活检在晚期肺癌靶向或免疫治疗中早期疗效监测的作用,但较少关注其在化疗中的疗效预测价值。求臻医学特邀武汉大学人民医院肿瘤中心姚颐教授,结合近期发表在CANCERS杂志上的文章进行解读。
姚颐教授:虽然肺癌是全球死亡率排在首位的恶性肿瘤,但其治疗手段相对较多,若在治疗初期监测疗效并及时优化治疗策略,将有效改善患者治疗结局。但目前实体瘤的疗效评价主要依赖影像学评估,存在一定的滞后性,且仅能观察肿瘤形态变化,而无法分析其内部克隆进化情况。液体活检是精准医学时代的新兴工具,具有灵活无创、可重复性强的特点,可用于肿瘤疗效评估、耐药或复发的动态监测。在既往研究中多集中于晚期肺癌靶向或免疫治疗中早期疗效监测的作用,鲜有研究探索利用ctDNA动态监测在化疗早期疗效预测中的作用。
今天分享的这篇发表于Cancers上的研究让我们看到了ctDNA动态变化对于晚期NSCLC化疗的指导价值。该研究共纳入92例IIIB-IV期NSCLC患者,利用NGS panel对接受化疗的患者进行ctDNA动态检测。分别在基线(B0)、第一次治疗后(P1)、第二次治疗后(P2)收集其血液样本进行ctDNA检测,将每毫升血浆中的平均突变分子数(MMPM)作为ctDNA的含量指标。
结果发现所有患者基线血浆样本中至少检出1个突变。基线、P1和P2各时间点的中位ctDNA水平分别为37.4、7.6和4.9,这表明多数患者在接受1周期化疗后ctDNA含量即出现下降,2周期化疗后这种现象仍存在。进一步分析发现,在治疗1周期后,ctDNA含量下降≤50%者相比ctDNA含量下降>50%者,6个月及12个月的PFS率均显著降低(6个月PFS率:33% vs 58%,HR=2.3,P=0.009;12个月PFS率:25% vs 70%,HR=4.3,P<0.001)。治疗2周期后ctDNA含量下降≤50%者生存时间亦显著缩短。研究者还发现,将ctDNA含量的阈值设定为10可用于区分应答者和非应答者的OS ,但该阈值和6个月的PFS率无显著关联,这表明治疗后PFS的预测仍需特异性基线指标的量化,这与RECIST标准要求参考基线CT扫描结果一致。
总之,该研究证实了肺癌患者进行NGS panel检测有较高的突变检出率,通过ctDNA动态监测可预测化疗早期疗效。对于无法取得组织标本的患者来说,基于血浆样本的检测是有效的补充手段。若无法提供基线血浆,治疗后单时间点ctDNA含量分析亦可监测疗效。未来,我们也期待有更多的研究证实ctDNA动态监测的临床应用价值,为患者带来更多获益,为精准治疗提供更多证据。
摘要
在治疗早期通过监测疗效可帮助临床及时改变治疗策略、改善患者预后。本研究利用NGS panel对接受化疗的晚期NSCLC患者进行ctDNA动态检测,发现治疗1周期后,ctDNA含量下降≤50%者相比ctDNA含量下降>50%者,6个月PFS率及12个月PFS率均显著降低(6个月PFS率:33% vs 58%,HR=2.3,P=0.009;12个月PFS率:25% vs 70%,HR=4.3,P<0.001)。治疗2周期后ctDNA含量下降≤50%者生存时间亦显著缩短。表明利用非侵入式的ctDNA含量分析可用于化疗早期疗效预测。
研究背景
在全球癌症相关死亡率中,肺癌位居首位,确诊后五年生存率仅10–30%。据美国最新分析显示,在治疗早期就采用更有效的治疗手段可将五年生存率从2014年的23.3%提高到2017年的26.4%。
如今,肺癌治疗选择也相对较多,若在治疗初期通过监测疗效并及时优化治疗策略,可有效改善患者治疗结局。然而目前实体瘤的疗效评价主要依赖于影像学评估,对于晚期NSCLC建议治疗后每6-8周或每6-12周进行评定,但这种标准方法仍有其局限性。
液体活检是精准医学时代的新兴技术手段,目前,通过量化ctDNA中肿瘤特异性突变变化,可进行早期疗效预测及监测多种肿瘤进展情况。既往已有研究证实ctDNA含量变化在晚期肺癌靶向或免疫治疗中早期疗效监测的作用,但鲜有研究关注化疗。本研究旨在探索ctDNA动态变化对于晚期NSCLC化疗的指导价值。
研究方法
研究纳入2015年12月至2018年3月于德国海德堡大学医院就诊的晚期肺腺癌或鳞癌患者。分别在基线(B0)、第一次治疗后(P1,第一疗程治疗开始后21-49天内)、第二次治疗后(P2,第二疗程治疗开始后21-49天内)(图1A)收集其血液样本进行ctDNA检测,将每毫升血浆中的平均突变分子数(MMPM)作为ctDNA的含量指标。与基线相比,ctDNA含量下降>50%的患者被定义为分子应答者。
研究结果
患者基线特征
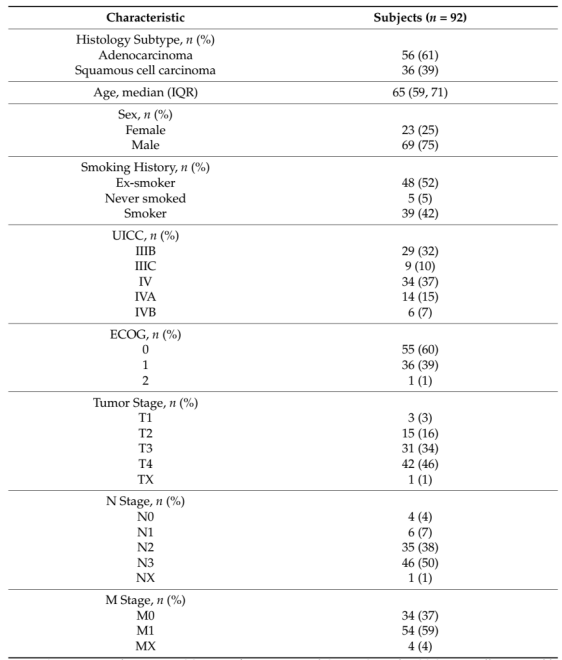
研究共纳入92例IIIB-IV期NSCLC患者,收集223个血浆样本。其中80例患者收集到B0、P1及P2时间点样本;51例患者仅收集到B0及P2时间点样本。60%患者为腺癌,剩余40%为鳞癌(表1)。
表1. 患者基线特征
ctDNA定量分析
所有患者基线血浆样本中都至少检出1个突变,用MMPM指标对每个突变进行定量,血浆样本中的ctDNA含量被概括为该样本中肿瘤特异性突变的平均MMPM。基线、P1和P2各时间点的中位ctDNA含量分别为37.4、7.6和4.9(图1B)。这表明多数患者在接受一个周期化疗后ctDNA含量即出现下降,2周期化疗后仍存在下降(图1C)。
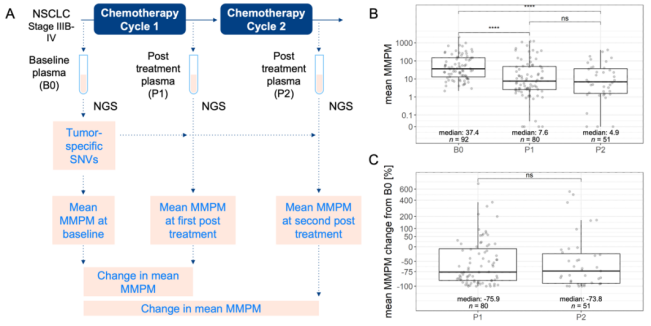
图1. 研究设计及ctDNA含量分布
ctDNA含量变化与临床预后
对比B0及P1各时间点的影像学评估结果和ctDNA含量变化(图2A),发现多数PR的患者其ctDNA含量下降。与基线相比,ctDNA含量下降>50%与治疗后达到PR呈显著相关(OR 13.15,95% CI 2.75–127.66, p < 0.001;图 2B)。
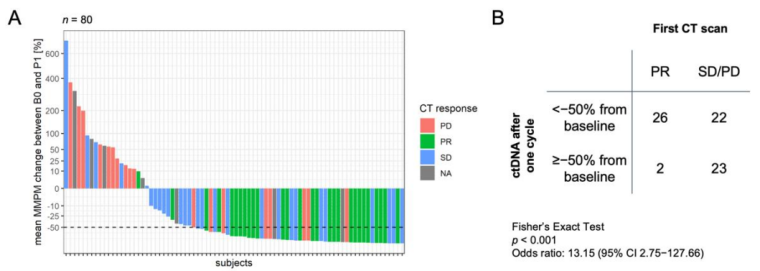
图2. 一疗程之后,疗效评估与ctDNA含量下降的相关性
P1 时间点ctDNA含量下降≤50%者相比其下降>50%者,6个月及12个月的PFS率均较低(图3A :6个月PFS率为33% vs 58%,HR=2.3,P=0.009;图3B :12个月PFS率为25% vs 70%,HR=4.3,P<0.001)。
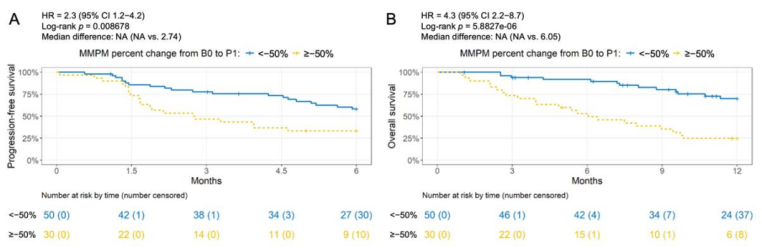
图3. 一疗程之后,生存期与ctDNA含量下降的相关性
经分期校正后,ctDNA含量下降≤50%与PFS仍呈显著相关(HR=1.9,P=0.041,图4A)。经放疗、ECOG评分及吸烟状态校正后,ctDNA含量下降≤50%与OS呈显著相关(图4B)。
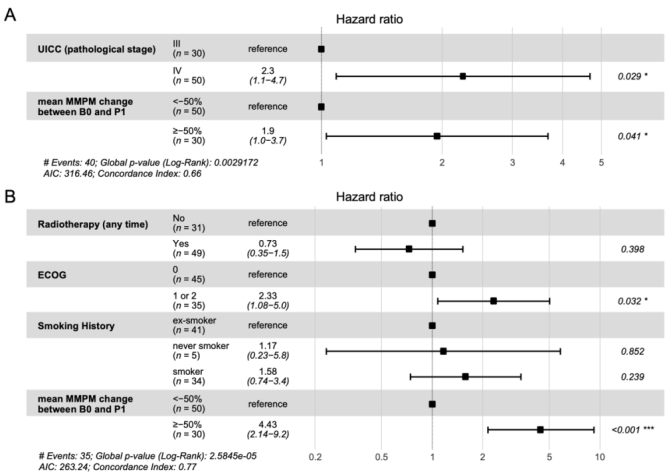
图4. 生存的多变量COX回归分析
P2 时间点ctDNA含量下降≤50%者相比其下降>50%者,6个月及12个月的PFS率也均较低(HR=4.43,P<0.001,图5)。
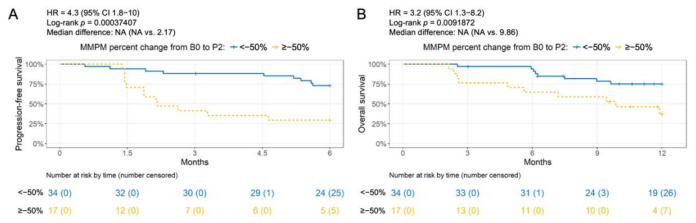
图5. 两疗程之后,生存期与ctDNA含量下降的相关性
单时间点ctDNA含量与临床预后
将80例可在P1时间点采集到血浆样本的患者以3:2比例随机分为训练组及验证组,两组患者组织学类型和年龄等临床特征均无显著差异。
经LogRank最大选择检验后,将区分OS的最佳ctDNA含量阈值设定为10,ctDNA含量≥10的患者,其12个月OS率显著降低,随即用该阈值在验证组数据进行分析,该结论亦成立。
将区分PFS的最佳ctDNA含量阈值设定为227,ctDNA含量≥227的患者,其6个月PFS率较低,且训练组和验证组结论一致。但该阈值较高,仅能将14%患者归类到非应答者。进一步用区分OS的阈值去做PFS分析,发现ctDNA含量≥10者的6个月的PFS率较低,但无统计学差异,P2时间点则由于样本太少而无法做训练组和验证组分析。
讨论
本研究结果表明,基于NGS panel分析ctDNA含量并用于晚期NSCLC患者化疗早期疗效监测是可行的。研究发现1或2周期化疗后ctDNA含量下降≤50%者其6个月的PFS率及12个月的OS率均显著降低。研究观察到P2时间点ctDNA含量下降≤50%者生存曲线出现更大分离,这可能是由于在一线治疗中治疗效果更加明显。
本研究92例患者在基线利用NGS panel检出至少一个可追踪的突变。针对有驱动基因突变的患者可利用其突变基因的动态变化来监测疗效,但对无明确驱动基因突变的患者则异质性较强,如何监测肿瘤负荷尚缺乏有效工具。
本研究证实了肺癌患者进行NGS panel有较高的突变检出率,通过ctDNA动态监测可预测化疗早期疗效。对于无法取得组织标本的患者来说,基于血浆样本的检测是有效的补充手段。若无法提供基线血浆,治疗后单时间点ctDNA含量分析亦可监测疗效。将ctDNA含量的阈值设定为10可以用于区分应答者和非应答者的OS ,但该阈值和6个月的PFS率无显著关联,这表明治疗后PFS的预测仍需特异性基线指标的量化,这与RECIST标准要求参考基线CT扫描结果一致。






