
近年来,伴随肿瘤靶向、免疫、核素治疗的发展,泌尿肿瘤领域取得长足进步。特别是以基因检测为代表的精准医学在泌尿肿瘤中的广泛应用,正在快速改变泌尿肿瘤领域诊疗模式。求臻医学聚焦重磅研究,紧追前沿热点,对泌尿肿瘤领域前沿进展进行梳理,特推出“探泌臻知”系列栏目。上期我们了解到靶向治疗在前列腺癌中的应用,本期,将着重介绍免疫治疗标志物在前列腺癌中的应用和探索,快跟随求小臻一起学习吧。

前列腺癌免疫标志物

近年来,随着免疫治疗的发展,以PD-1/PD-L1为代表的免疫检查点抑制剂在肺癌、结直肠癌、肾癌等癌种中不断取得突破进展。但在前列腺癌中,免疫检查点抑制剂在未经选择的患者中疗效不甚理想。前列腺癌属于免疫学上的荒漠型冷肿瘤,体细胞突变相对较少、肿瘤缺乏T细胞浸润,因此对于前列腺癌的免疫治疗,需要通过生物标志物筛选获益人群才能有助于进一步发挥免疫检查点抑制剂的疗效。
目前,可能影响前列腺癌免疫检查点抑制剂疗效的生物标志物包括: TMB(肿瘤突变负荷)、MSI/MMR(微卫星不稳定/错配修复)、细胞周期依赖性蛋白12(cyclin-dependent kinase 12, CDK12)基因等,更多影响免疫疗效的生物标志物还在不断的研究与探索中。
TMB和MSI/MMR
2017年5月,FDA批准帕博利珠单抗用于之前接受治疗后疾病进展且没有令人满意的替代治疗方案的、成人和儿童不可切除的或转移性高度微卫星不稳定性(MSI-H)或错配修复缺陷(dMMR)的实体瘤患者。
2020年06月17日, FDA批准帕博利珠单抗作为单药疗法,用于治疗先前治疗后病情进展、无令人满意的替代治疗选择、不可切除性或转移性高肿瘤突变负荷(TMB-H:≥10个突变/兆碱基[mut/Mb])的实体瘤患者。Abida 等人对11 名 MSI-H/dMMR 转移性去势抵抗性前列腺癌(metastatic castration-resistant prostate cancer, mCRPC)患者使用了免疫检查点抑制剂治疗。其中 6 人 (54.5%) 的前列腺特异性抗原(PSA)水平下降超过 50%[1]。
另一项晚期前列腺癌大型回顾性研究发现,与接受紫杉烷类化疗的患者相比,TMB<10mt/Mb的患者在接受免疫检查点抑制剂治疗后的至下一次治疗时间(TTNT)更差(2.4月vs 4.1月,HR=2.65,p<0.01),但总生存期(OS)没有显著差异;而对于TMB≥10mt/Mb的患者,接受免疫检查点抑制剂治疗后的TTNT得到改善(8.0月vs 2.4月,HR=0.37,p=0.02),且OS也显著延长(19.9月vs 4.2月,HR=0.23,p=0.001)[2]。前列腺癌NCCN指南也推荐TMB≥10mt/Mb或dMMR/MSI-H的mCRPC患者在后线接受帕博利珠单抗治疗(图1)。

图1. 前列腺癌NCCN指南
CDK12基因
CDK12基因的缺失会影响DNA损伤修复,进而导致基因融合、新抗原负荷和T细胞浸润的增加。在中国人群中CDK12的突变频率约为15.4%[3],远远高于高加索人群的4.7%[4]。已有多个研究表明,CDK12突变的前列腺癌患者更能从免疫检查点抑制剂治疗中获益。WU等人对4例CDK12双位点失活的mCRPC患者使用PD-1抑制剂单药治疗,其中2例明显获益[5]; Antonarakis等人对9例CDK12突变mCRPC患者使用纳武利尤单抗治疗,其中3例达到了部分缓解(PR)[6]。
预测前列腺癌免疫检查点抑制剂单药治疗疗效的有效生物标志物仍然有限,需进一步探索和明确。
免疫治疗标志物在免疫联合治疗中的探索

总体上,免疫检查点抑制剂单药在前列腺癌患者的治疗上效果不佳。近年来,为了提高晚期前列腺癌患者对免疫检查点抑制剂的响应程度,免疫联合治疗的临床试验层出不穷,目前已有不少研究获得可观的临床结果。是否有指导疗效的生物标志物也是联合治疗中的探索重点。
免疫检查点抑制剂联合PARP抑制剂
CheckMate 9KD研究中队列A1纳入88例既往1-2线紫杉烷类方案化疗失败,及接受至多2种新型内分泌治疗失败的mCRPC患者,治疗方案为纳武利尤单抗联合PARP抑制剂Rucaparib。分层结果显示同源重组修复缺陷(Homologous Recombination Deficiency,HRD)阳性和HRD阴性患者的中位放射学无进展生存期(rPFS)分别为5.8个月和3.7个月,中位OS分别为15.4个月和9.4个月[7]。研究提示HRD阳性患者更能从免疫检查点抑制剂联合PARP抑制剂的治疗中获益(图2)。
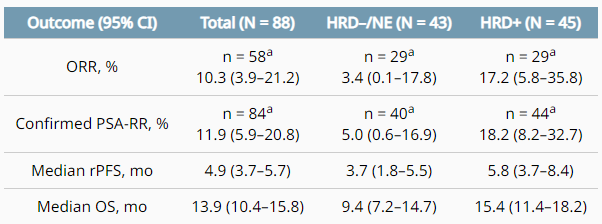
图2. CheckMate 9KD队列A1中HRD与ORR、PFS及OS的关系
双免联合
CheckMate 650研究中纳入未经化疗与经过化疗后进展的mCRPC患者各45例,治疗方案为纳武利尤单抗联合伊匹木单抗。随访6个月后的分析结果提示,未使用化疗直接使用该组合的患者与使用化疗后再用该组合的患者客观缓解率(ORR)分别为25%和10%,中位rPFS 分别为5.5 和3.8个月,中位OS 分别为19.0 和15.2 个月[8]。在高TMB、HRD阳性 、DNA损伤修复(DNA Damage Repair, DDR)基因突变、PD-L1阳性(≥1%)患者中体现出更高的疗效(图3)。
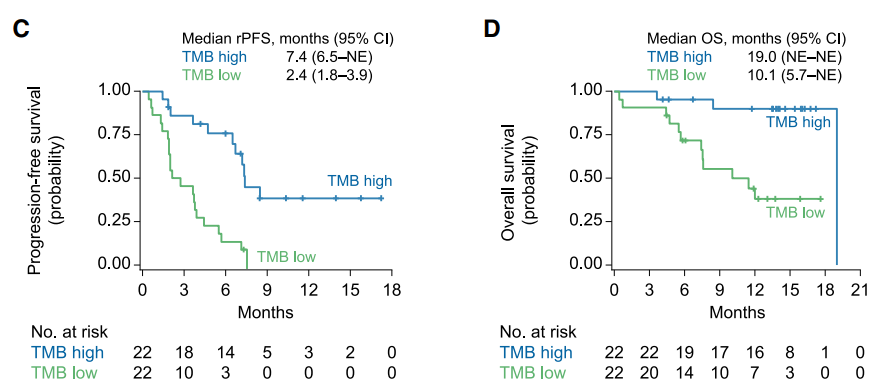
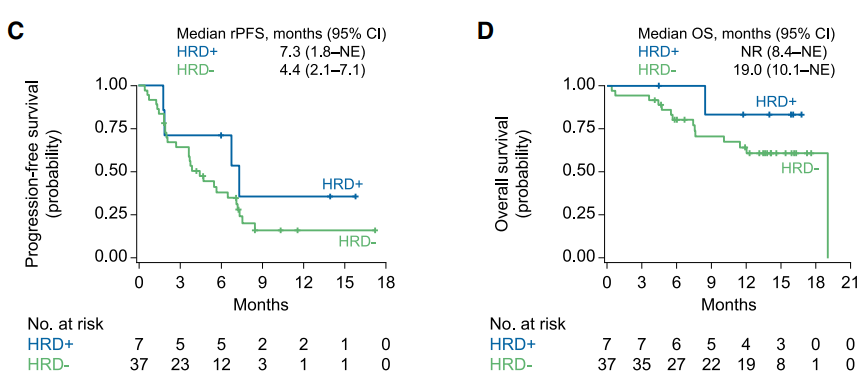
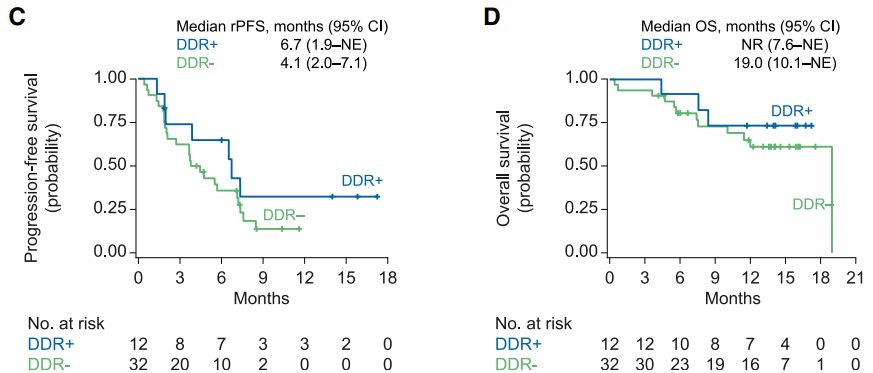
图3. CheckMate 650中TMB、HRD、DDR与PFS及OS的关系
免疫检查点抑制剂联合化疗
CheckMate 9KD研究中队列B纳入84例既往未接受过化疗的mCRPC患者,但允许患者既往接受至多2种新型内分泌治疗,治疗方案为纳武利尤单抗联合多西他赛。研究结果显示,ORR为40%,中位无进展生存期(PFS)为9个月,中位OS18.2个月[9]。但在生物标志物探索中发现, HRD或 TMB 与对纳武利尤单抗联合多西他赛的响应之间没有明确的关联(图4)。
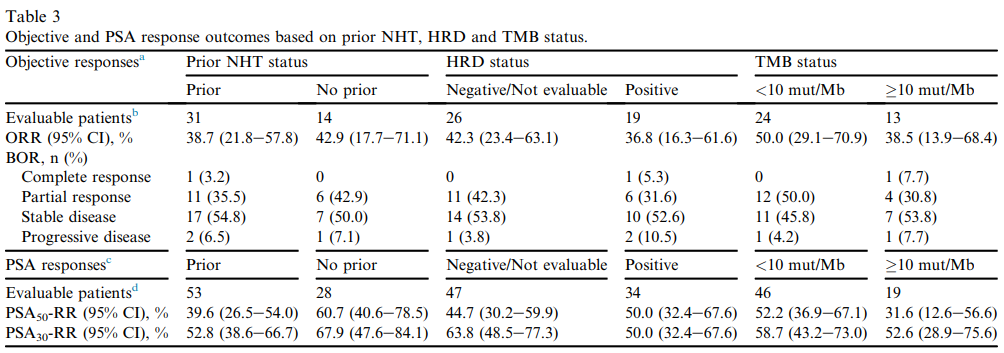
图4. CheckMate 9KD队列B中TMB、HRD与ORR和PSA响应的关系
免疫检查点抑制剂联合抗血管类靶向
COSMIC-021研究纳入132例恩扎卢胺和/或阿比特龙治疗后进展的mCRPC患者,治疗方案为卡博替尼联合阿特珠单抗。中位随访15.2个月,ORR达到23%,DCR(疾病控制率)达到84%,中位PFS为5.5个月,但未观察到PD-L1状态与疗效之间的相关性(图5)[10]。
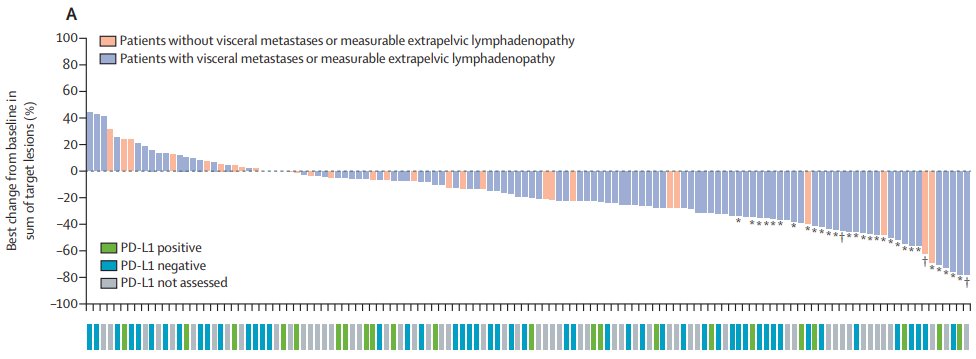
图5. COSMIC-021中PD-L1与病灶缓解的关系
从上述研究可以看出,HRD阳性可能能够预测免疫检查点抑制剂联合PARP抑制剂的疗效,PD-L1、TMB、DDR和HRD可能是双免联合治疗的有效生物标志物。而免疫检查点抑制剂联合化疗或抗血管类靶向治疗的生物标志物仍需进一步探索。
总结

前列腺癌中存在与免疫检查点抑制剂反应相关的预测性生物标志物。但在不同的免疫联合治疗方式中,生物标志物的预测作用还存在出入,需要更多临床研究数据的积累。相信未来在免疫治疗标志物的筛选下,会有更多的晚期前列腺癌患者通过免疫治疗获益,为末线难治患者带来新的希望。

求臻医学
泌尿系列肿瘤基因检测方案
求臻医学从临床诊疗痛点出发,与泌外科顶级专家团队开展深度合作,结合最新研究进展深度打磨泌尿系列专属产品,全面覆盖前列腺癌、膀胱癌、肾癌等泌尿肿瘤多个治疗阶段,满足临床不同需求;同时针对患者疾病诊疗史进行个体化精准解读,辅助临床治疗决策;作为《中国肿瘤基因图谱计划》(CGAC)项目的转化成果,该系列产品定制化设计了国内外泌尿肿瘤高频突变基因panel,紧跟泌尿前沿贴近中国临床实践;通过指导肿瘤精准用药、疗效监控及健康管理提供全面有效的参考信息,为泌尿肿瘤患者保驾护航!






