近年来,随着早中期肿瘤患者预后管理相关研究的不断深入,肿瘤复发风险及分子残留病灶(MRD)已愈来愈受到临床的关注,并正在快速改变着肿瘤诊疗模式。求臻医学倾力打造“臻话MRD”系列文章,为您阐述MRD检测能为临床及患者带来的获益,解析不同的技术路径的区别,帮助挑选合适的MRD检测产品。


01
肺癌流行病学


在所有癌症类型中,肺癌是癌症相关死亡的主要原因,占癌症相关死亡的21%[1]。非小细胞肺癌(NSCLC)是最常见的肺癌类型,肺腺癌(LUAD)占所有NSCLC病例的50%以上。随着手术方式的不断革新,对可手术的早中期患者带来极大生存获益[2]。但肺癌总体生存期仍然差强人意,尤其是随着分期越晚,患者生存期越短,根据统计显示I期5年生存率为80%至92%,II期为65%至74%,在III期仅为57%,IV期47%[3]。

02
NSCLC辅助治疗研究进展

为了使患者有更好的生存获益,切除的非小细胞肺癌需要辅助治疗。目前对于围手术期术后辅助治疗方式主要分为化疗、靶向、免疫。以顺铂为基础的辅助化疗目前是IIA-IIIB期非小细胞肺癌(NSCLC)根治性手术后的标准治疗方案[4,5]。然而,5年生存率仍然不令人满意,超过60%的患者出现了令人担忧的3级毒性[6]。针对EGFR突变阳性的术后靶向研究改变了II-IIIA期EGFR突变阳性NSCLC辅助治疗的临床实践。埃克替尼和奥希替尼目前已经获批术后辅助临床适应症。
在第一代EGFR-TKI 埃克替尼的EVIDENCE研究(II~IIIA期)和CORIN研究(IB期)研究证实,中位DFS为47.0个月,而标准化疗仅为22.1个月(HR=0.36,P<0.0001),降低复发或死亡风险达64%,3年的无病生存率分别为63.6%和31.7%[7]。CORIN研究(IB期)研究证实,埃克替尼组相比观察组,3年mDFS显著提高(HR=0.20,95%CI:0.04~0.89,P=0.018);3年无病生存率分别为95.3%和86.7%[8]。第三代EGFR-TKI奥希替尼的ADAURA研究证实其对DFS有显著改善,且无论患者处于何种分期,接受辅助化疗均无额外获益(ⅠB期:HR=1.47,95%CI:0.33~6.42;Ⅱ期:HR=0.42; 95%CI:0.12~1.51;ⅢA期:HR=0.81,95%CI:0.20~3.23)[9]。然而,约19%至40%的TKI治疗患者在这些试验后仍复发[10,11]。
基于IMpower010以及KEYNOTE-091研究结果,阿替利珠单抗和帕博利珠单抗开启肺癌术后辅助治疗新里程[33,34],IMpower010研究结果显示,阿替利珠单抗辅助免疫治疗对比最佳支持治疗(BSC),延长了PD-L1 TC≥1%的II-IIIA期NSCLC患者的总生存期(HR=0.71,95%CI:0.49-1.03),主要是PD-L1 TC≥50%人群OS改善更为突出(HR=0.42,95%CI:0.23-0.78)[33]。KEYNOTE-091研究结果显示无论PD-L1表达情况,帕博利珠单抗用于手术切除后IB-IIIA期非小细胞肺癌(NSCLC)患者的辅助治疗,相比安慰剂,均显著改善了患者的无病生存期(DFS)[HR 0.76(95%CI 0.63-0.91),p=0.0014] [34];但如何筛选获益人群以及疗效预后评估,目前仍然是临床关注的焦点。

03
NSCLC预后评估以及
复发风险预测研究进展

因此,准确及时地确定复发风险高以及预后较差的患者可能为提早给早期LUAD患者的临床干预提供机会。目前对于患者术后复发评估手段临床主要以影像学、血液肿瘤标志物以及临床病理特征为主,但影像学主要评估物理性变化病灶为主,而肿标因受各种因素干扰对于疾病判断准确性有待提高,例如临床会出现假阳性而对临床诊断造成困扰。而根据NCCN NSCLC 2023 V2指南推荐Ib期-IIa期NSCLC根治术后建议观察或高危人群进行化疗,IIb期-IIIa期行化疗,对EGFR突变阳性的Ib期-IIIa期患者根治术后无论是否接受辅助化疗,均可以使用奥希替尼靶向辅助治疗。 临床病理性高危因素包括低分化肿瘤(包括肺神经内分泌肿瘤,不包括分化良好的神经内分泌肿瘤)、血管浸润、楔形切除、脏层胸膜受累和淋巴结状态不明(Nx)[12]。
除此之外,相关研究证实气道播散、微乳头等临床病理因素也是NSCLC高危因素[13-21]。但病理性标志物因受诸多因素干扰,也未能准确预测高危人群。因此一个精准且早于影像学评估复发或疗效评价的生物标志物,是目前外科医生所重点关注的目标。随着NGS基因检测技术的发展,精准治疗在很多瘤种进展非常迅速。以ctDNA为标志物的液态活检技术来评估微小残留病灶(minimal residual disease,MRD)或分子残留病灶(molecular residual disease,MRD)检测在肺癌肠癌等实体瘤中的证据不断积累,其价值及应用前景逐步开发当中[22-31],亦是临床重点关注的方向。

04
MRD概念


非小细胞肺癌分子残留病灶专家共识指出, 肺癌分子残留病灶(Molecular Residue Disease):经治疗后,传统影像学(包括PET/CT)或实验室方法不能发现,但通过液体活检发现的癌来源分子异常,代表着实体瘤的持续存在和临床进展可能。而其中肺癌分子异常:指的是外周血可稳定检出丰度≥0.02%的ctDNA,包括肺癌驱动基因或其他的I/II 类基因变异[32]。因其检测灵敏高,MRD相比影像学更容易发现“冰山”更深层次的分子异常,因此目前MRD逐渐作为一种辅助临床诊断的生物标志物,与影像学和肿标一起评估肺癌术后复发风险以及预后疗效。

自从2017年TRACERx 研究中通过追踪前期入组 100 例早期NSCLC患者术后血液标本,揭示了早期肺癌术后复发 ctDNA 系统进化轨迹,此研究奠定了MRD研究的理论基础。紧接着,2017年CAPP-seq研究证实:ctDNA-MRD可以初步评估根治性治疗患者复发风险,因此MRD逐渐受到临床关注,相关研究也在如火如荼开展。随后在2019年DYNAMIC研究初步证实:术后MRD采血时间节点在3天之后,为后续MRD研究采血的时间节点提供了方向[22-24]。

05
MRD在围手术期
NSCLC精准诊疗中的应用

本文根据近几年MRD重磅研究,汇总了目前MRD在肺癌中的应用。
MRD在肺癌中的应用
左右滑动查看更多
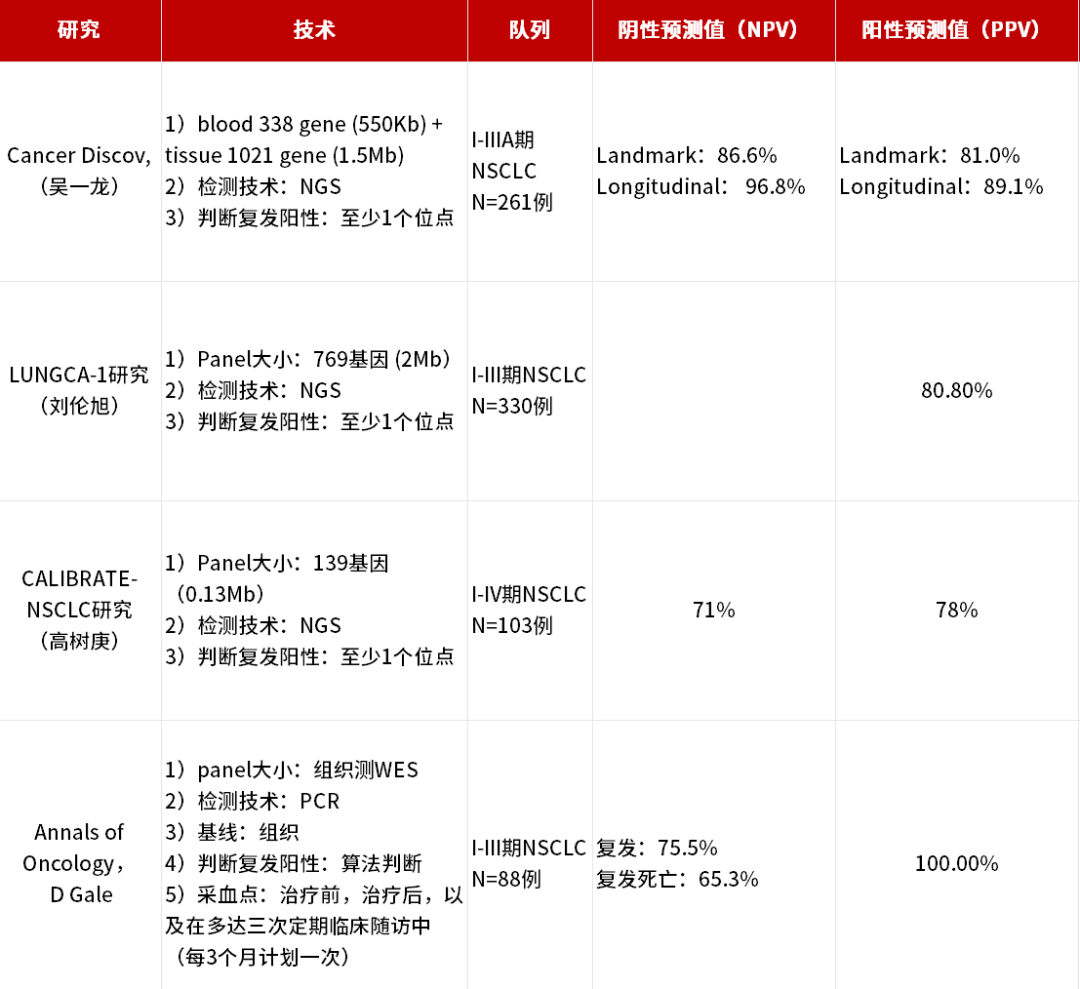
![]() 术后MRD状态可以为NSCLC术后复发风险提供参考。根据CALIBRATE-NSCLC研究、LUNGCA研究和吴一龙教授发表在在Cancer Discovery的MRD研究提示,与MRD阴性患者相比,术后MRD阳性患者具有较高的复发风险;在CALIBRATE-NSCLC研究中,纳入116例接受了手术的NSCLC患者,最终103例患者数据纳入分析;对85例患者术后1个月内单个时间节点血浆样本进行MRD检测,18例患者术后MRD阳性,与MRD阴性患者相比,术后MRD阳性患者更易复发(HR:4.0; 95% CI:2.0–8.0; p < 0.001)[25];LUNGCA-1研究中纳330例I~III期NSCLC患者,结果显示术后一个月内ctDNA-MRD阳性患者的复发率80.8%(21/26),显著高于阴性患者16.2%(49/303)(P<0.001),而且MRD阳性患者属于术后复发高风险人群(HR,11.1;95%CI,6.5~19.0;P<0.001)[26];吴一龙教授在Cancer Discovery杂志(IF:39.397)上发表的肺癌MRD超大研究队列,共纳入261例可手术肺癌患者、913个外周血样本;肺癌MRD的阴性预测值达到96.8%,从而首次定义了潜在治愈人群。术后标志性时间节点(Landmark)检测阴性患者复发风险显著低于阳性患者(HR=0.08,95%CI:0.02-0.33)[27];术后ctDNA-MRD状态是术后患者复发预测的显著指标;
术后MRD状态可以为NSCLC术后复发风险提供参考。根据CALIBRATE-NSCLC研究、LUNGCA研究和吴一龙教授发表在在Cancer Discovery的MRD研究提示,与MRD阴性患者相比,术后MRD阳性患者具有较高的复发风险;在CALIBRATE-NSCLC研究中,纳入116例接受了手术的NSCLC患者,最终103例患者数据纳入分析;对85例患者术后1个月内单个时间节点血浆样本进行MRD检测,18例患者术后MRD阳性,与MRD阴性患者相比,术后MRD阳性患者更易复发(HR:4.0; 95% CI:2.0–8.0; p < 0.001)[25];LUNGCA-1研究中纳330例I~III期NSCLC患者,结果显示术后一个月内ctDNA-MRD阳性患者的复发率80.8%(21/26),显著高于阴性患者16.2%(49/303)(P<0.001),而且MRD阳性患者属于术后复发高风险人群(HR,11.1;95%CI,6.5~19.0;P<0.001)[26];吴一龙教授在Cancer Discovery杂志(IF:39.397)上发表的肺癌MRD超大研究队列,共纳入261例可手术肺癌患者、913个外周血样本;肺癌MRD的阴性预测值达到96.8%,从而首次定义了潜在治愈人群。术后标志性时间节点(Landmark)检测阴性患者复发风险显著低于阳性患者(HR=0.08,95%CI:0.02-0.33)[27];术后ctDNA-MRD状态是术后患者复发预测的显著指标;
![]() 术后MRD状态提示患者能否从术后辅助方案中获益。在MRD初步解答了哪些患者是高危人群之后,同时也提示MRD阳性患者能够从术后辅助治疗中获益。在CALIBRATE-NSCLC研究中,术后MRD阳性患者中,接受辅助治疗的患者复发风险相比未接受辅助治疗的患者大大降低(p < 0.05),而术后MRD阴性患者无论是否接受辅助治疗复发风险均较低,2组患者没有统计学差异(p=0.46)[25];而在LUNGCA-1研究中在26例MRD阳性患者中,接受辅助治疗的17例患者中有5例保持无复发状态,而未接受辅助治疗的9例患者均出现复发,因此接受辅助治疗的MRD阳性患者的RFS显著优于未接受辅助治疗的患者(HR,0.3;95%CI,0.1~0.8;P=0.008);MRD阴性患者接受辅助治疗,RFS反而更差(HR,3.1;95%CI,1.7~5.5;P<0.001)[26];吴一龙教授在Cancer Discovery杂志(IF:39.397)上发表的肺癌MRD超大研究队列研究中,术后Pre-adjuvant节点MRD检测阳性的患者,辅助治疗能够显著改善其DFS(P = 0.022;HR = 0.34; 95% CI, 0.12-0.88),但是对于MRD阴性的人群,辅助治疗无获益。这提示相比于MRD阳性患者,MRD阴性患者可能无法从术后辅助治疗中获益(P = 0.482;HR = 1.59; 95% CI, 0.43-5.93)[27];
术后MRD状态提示患者能否从术后辅助方案中获益。在MRD初步解答了哪些患者是高危人群之后,同时也提示MRD阳性患者能够从术后辅助治疗中获益。在CALIBRATE-NSCLC研究中,术后MRD阳性患者中,接受辅助治疗的患者复发风险相比未接受辅助治疗的患者大大降低(p < 0.05),而术后MRD阴性患者无论是否接受辅助治疗复发风险均较低,2组患者没有统计学差异(p=0.46)[25];而在LUNGCA-1研究中在26例MRD阳性患者中,接受辅助治疗的17例患者中有5例保持无复发状态,而未接受辅助治疗的9例患者均出现复发,因此接受辅助治疗的MRD阳性患者的RFS显著优于未接受辅助治疗的患者(HR,0.3;95%CI,0.1~0.8;P=0.008);MRD阴性患者接受辅助治疗,RFS反而更差(HR,3.1;95%CI,1.7~5.5;P<0.001)[26];吴一龙教授在Cancer Discovery杂志(IF:39.397)上发表的肺癌MRD超大研究队列研究中,术后Pre-adjuvant节点MRD检测阳性的患者,辅助治疗能够显著改善其DFS(P = 0.022;HR = 0.34; 95% CI, 0.12-0.88),但是对于MRD阴性的人群,辅助治疗无获益。这提示相比于MRD阳性患者,MRD阴性患者可能无法从术后辅助治疗中获益(P = 0.482;HR = 1.59; 95% CI, 0.43-5.93)[27];
![]() 辅助治疗之后MRD状态提供术后辅助治疗疗效评估参考。在CALIBRATE-NSCLC研究中,对64例接受辅助治疗患者辅助治疗后的血浆样本进行MRD检测,结果显示辅助治疗后MRD阳性患者复发风险显著高于MRD阴性患者(HR:3.2; 95% CI:1.3–8.2; p < 0.05)[25];
辅助治疗之后MRD状态提供术后辅助治疗疗效评估参考。在CALIBRATE-NSCLC研究中,对64例接受辅助治疗患者辅助治疗后的血浆样本进行MRD检测,结果显示辅助治疗后MRD阳性患者复发风险显著高于MRD阴性患者(HR:3.2; 95% CI:1.3–8.2; p < 0.05)[25];
![]() 动态MRD状态用于实时监测NSCLC术后复发状态。在CALIBRATE-NSCLC研究中,89例在治疗后监测期间的任何时间点可检测到 ctDNA 的患者的 RFS 显着低于手术后 ctDNA 检测始终为阴性的患者(HR,8.5;95% CI,3.7-20;p < 0.001)[25];吴一龙教授在Cancer Discovery杂志(IF:39.397)上发表的肺癌MRD超大研究队列研究中,在纵向时间节点(Longitudinal) ctDNA阴性患者中预后显著优于阳性患者(HR = 0.02; 95% CI, 0.01–0.05),并且持续的获益与临床分期无关,同时II-III期肺癌MRD转阳或复发的高峰期为术后12~18个月,术后18个月MRD未检出的患者为潜在治愈人群[27];
动态MRD状态用于实时监测NSCLC术后复发状态。在CALIBRATE-NSCLC研究中,89例在治疗后监测期间的任何时间点可检测到 ctDNA 的患者的 RFS 显着低于手术后 ctDNA 检测始终为阴性的患者(HR,8.5;95% CI,3.7-20;p < 0.001)[25];吴一龙教授在Cancer Discovery杂志(IF:39.397)上发表的肺癌MRD超大研究队列研究中,在纵向时间节点(Longitudinal) ctDNA阴性患者中预后显著优于阳性患者(HR = 0.02; 95% CI, 0.01–0.05),并且持续的获益与临床分期无关,同时II-III期肺癌MRD转阳或复发的高峰期为术后12~18个月,术后18个月MRD未检出的患者为潜在治愈人群[27];
![]() MRD阳性可早于影像学提示NSCLC复发。国内外多项研究显示,相比于影像学提示复发,ctDNA-MRD可至少提前2个月发现NSCLC复发[25-28];
MRD阳性可早于影像学提示NSCLC复发。国内外多项研究显示,相比于影像学提示复发,ctDNA-MRD可至少提前2个月发现NSCLC复发[25-28];
![]() MRD在围手术期NSCLC中的预后提示价值。发表于Annals of Oncology(IF:51.769)一项MRD研究提示,在治疗结束后2周至4个月(MRD评估时间段)内MRD阳性患100%复发,且与MRD阴性患者相比总生存期OS更短(HR 5.48, P<0.0003)[28];
MRD在围手术期NSCLC中的预后提示价值。发表于Annals of Oncology(IF:51.769)一项MRD研究提示,在治疗结束后2周至4个月(MRD评估时间段)内MRD阳性患100%复发,且与MRD阴性患者相比总生存期OS更短(HR 5.48, P<0.0003)[28];
![]() MRD可作为NSCLC新辅助/辅助免疫治疗疗效预测的生物标志物。CheckMate816研究发现ctDNA清除率与病理学缓解相关。纳武利尤单抗联合组和化疗组ctDNA清除率分别为56%和34%;ctDNA清除组中,纳武利尤单抗联合组和化疗组的pCR率分别为46%和13%,而ctDNA未清除组中,纳武利尤单抗联合组的pCR率为0 [29]。NADIM II研究提示,新辅助治疗后无法检测到ctDNA水平,这与PFS和OS的改善显着相关(HR:0.26;HR:0.04)。新辅助治疗后根据ctDNA水平预测OS的C指数(0.82)优于 RECIST标准(0.72)[30] 。IMpower010研究提示ctDNA阳性是治疗获益较差的预后因素,在II-IIIA期的NSCLC患者中,无论阿替利珠组还是BSC组,与ctDNA阴性患者相比,ctDNA阳性患者的DFS更短[31]。
MRD可作为NSCLC新辅助/辅助免疫治疗疗效预测的生物标志物。CheckMate816研究发现ctDNA清除率与病理学缓解相关。纳武利尤单抗联合组和化疗组ctDNA清除率分别为56%和34%;ctDNA清除组中,纳武利尤单抗联合组和化疗组的pCR率分别为46%和13%,而ctDNA未清除组中,纳武利尤单抗联合组的pCR率为0 [29]。NADIM II研究提示,新辅助治疗后无法检测到ctDNA水平,这与PFS和OS的改善显着相关(HR:0.26;HR:0.04)。新辅助治疗后根据ctDNA水平预测OS的C指数(0.82)优于 RECIST标准(0.72)[30] 。IMpower010研究提示ctDNA阳性是治疗获益较差的预后因素,在II-IIIA期的NSCLC患者中,无论阿替利珠组还是BSC组,与ctDNA阴性患者相比,ctDNA阳性患者的DFS更短[31]。

总之,伴随着液体活检在肺癌精准诊疗中应用,ctDNA-MRD目前在整个围手期辅助临床诊断方面具有重要的临床意义,而且受到相关专家共识的推荐。MRD目前对于根治性手术患者是一个具有预测价值的biomarker,同时可以评估术后辅助治疗疗效,且可以早于影像学评估复发风险;除了评估根治性手术患者人群,对于不可切除根治性放化疗患者人群,或者术后辅助,免疫新辅助研究等评估也具有很大临床研究价值;伴随着多项干预性临床试验的开展,在未来以MRD为结果的临床诊疗,有望改写肺癌治疗结局,给患者带来极大的生存获益。

ChosenPace®MRD动态监测2.0方案
定制化+固定化&AI双驱动策略
求臻医学自主研发,创造性地打造了ChosenPace®MRD动态监测2.0方案,基于患者肿瘤组织的1123个基因突变情况(基线),筛选定制化Panel(Informed策略),结合肿瘤高发变异的MRD Panel(Agnostic策略),实现AI双驱动策略下的超高深度测序。同时,通过深度学习神经网络对十万人大数据背噪库及克隆性造血数据库训练,实现九重联合置信分析,并定期追踪ctDNA状态,进行MRD的动态监测。
ChosenPace®MRD2.0的基线组织检测在分析DNA水平的同时,还涵盖常见融合基因的RNA表达情况及相关肿瘤的HRD状态,综合评估TMB、MSI、HLA分型等免疫治疗标志物及上百个免疫治疗正负向基因,提供全面准确的个体化诊疗信息,构建了肿瘤“筛、诊、治、监、预后”的完美闭环。