臻享会首期回顾 近日,臻享会系列直播栏目首期线上会议圆满结束。本次会议邀请了誉衡生物研发总监杨芳,普米斯生物转化科学部负责人郭冬阳以及中国科学院计算机网络信息中心研究员&求臻医学首席信息官牛北方三位业内专家,围绕肿瘤免疫药物研发中Biomaker的探索、应用、进展以及MSI检测技术发展等话题进行了精彩的学术报告和深入探讨。
part/1 报告环节 杨 芳 誉衡生物研发总监 Biomarker在肿瘤药物研发中的应用
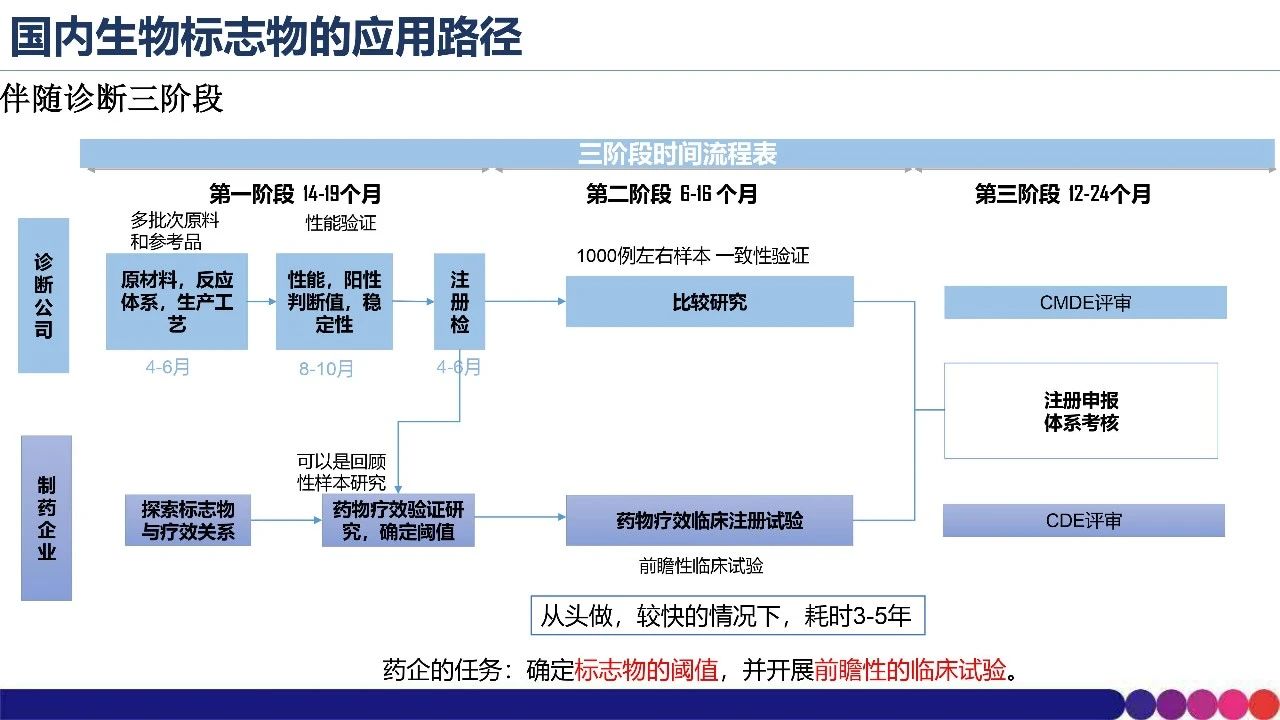
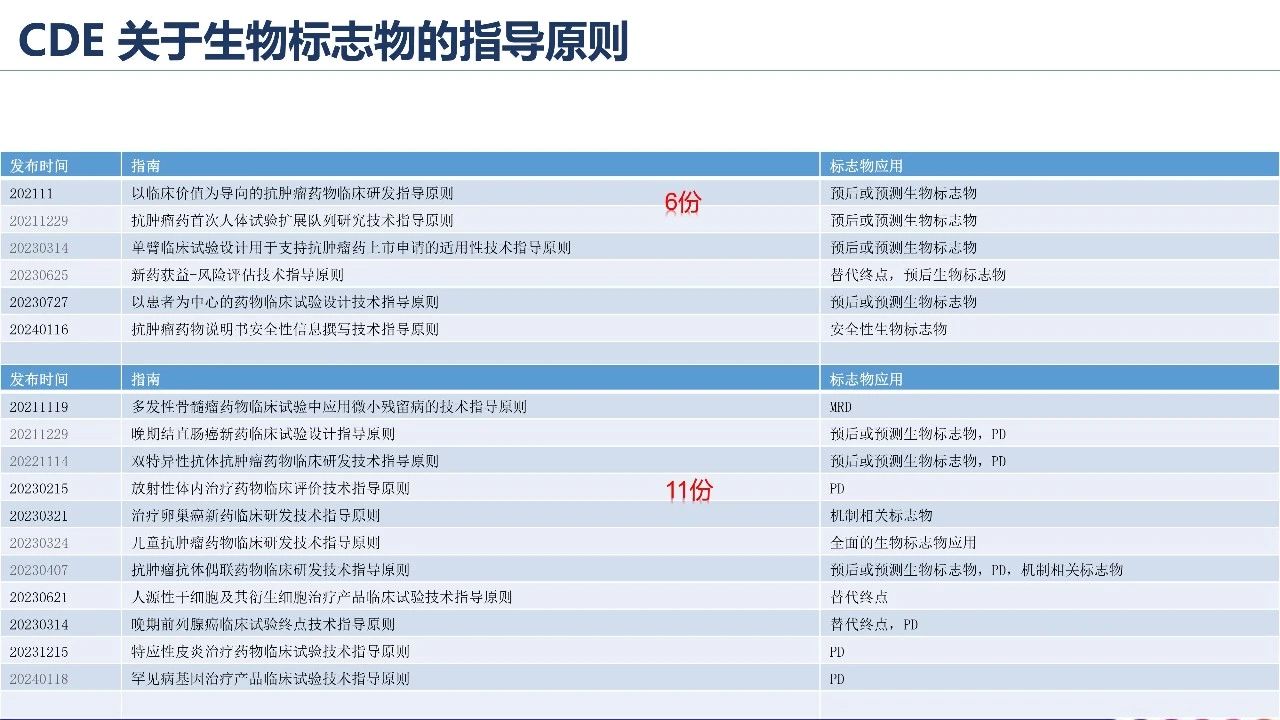
杨芳博士主要从肿瘤起源及异质性、标志物应用及流程、标志物应用指导原则三个角度进行阐述。 清楚认识肿瘤起源及异质性对药物临床研究过程中合理的采样至关重要,以便收集全面信息来评估标志物结果的可靠性。由于肿瘤免疫逃逸机制,肿瘤细胞具备抵抗免疫系统清除的功能,发展为具有临床表现的肿瘤,在肿瘤发生和转移过程中,恶性细胞呈现渐增多样化、更具异质性。 生物标志物在抗肿瘤新药研发中发挥着十分重要的作用,已有多个抗肿瘤药物因合理应用生物标志物而提高了临床研发效率。 此外,从国内生物标志物应用路径出发,杨芳博士介绍了免疫检查点抑制剂伴随诊断开发的三个阶段;同时,普及了CDE发布的关于生物标志物的指导原则,进一步加深大家对指导原则的理解,从而可以合理应用生物标志物指导抗肿瘤药物的临床研发。
郭东阳 普米斯生物转化科学部负责人 免疫联合ADC疗法的biomarker策略初探
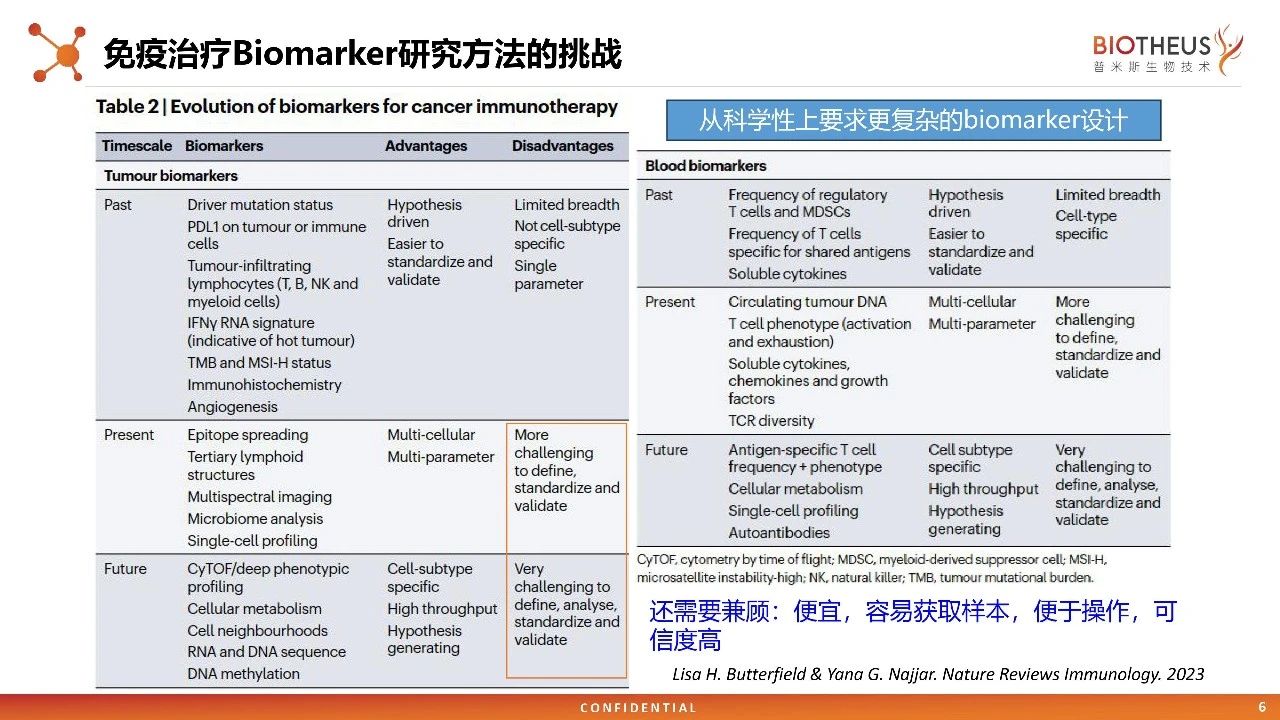
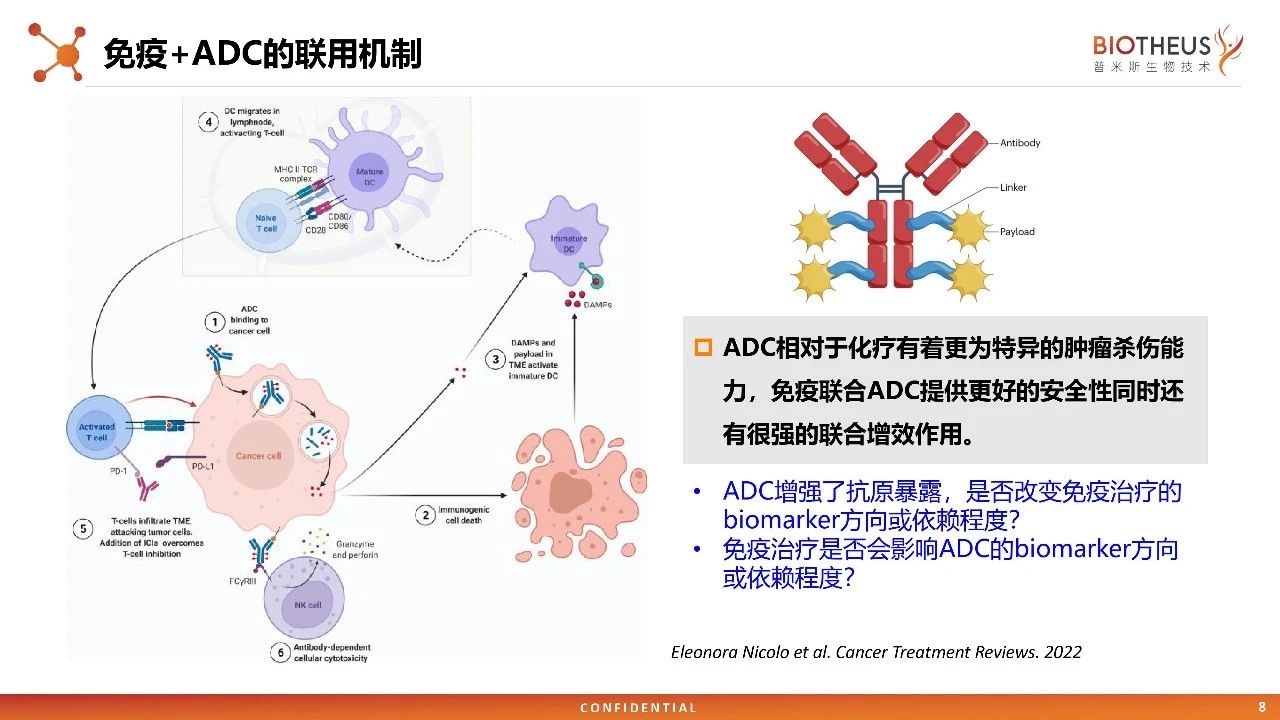
肝癌免疫治疗IMbrave150 研究公开结果显示,阿替利珠单抗与贝伐珠单抗联合疗法在OS和PFS上都达到了具有统计学意义和临床意义的改善,生物标志物分析发现,高PD-L1水平、高CD8+T细胞密度与阿替利珠单抗+贝伐珠单抗临床结局改善高度相关。实现精准高效的免疫治疗,不同药物的组合需要强有力的生物学原理依据和前瞻性的生物标志物。 由于精准的免疫治疗存在靶点、药物设计、药物联用、TME等方面的复杂性,所以需要对生物标志物进行更为广泛和深层次的分析,开发设计出经验证的有效载荷作用机制(MoAs)的治疗药物,以不断完善癌症免疫治疗联合用药的治疗策略。 ADC药物对肿瘤细胞进行杀伤,释放新的抗原,启动抗原呈递,最终产生免疫效应。在机制方面,ADC 与免疫治疗联用似乎可以起到 1+1>2 的效果。目前,ADC与免疫治疗联用已经成为多个瘤种的探索方向,其中,已有多个癌种的临床试验数据显示,免疫联用ADC展现出较好的疗效。
牛北方 中国科学院计算机网络信息中心 研究员 & 求臻医学首席信息官 测序技术及数字病理融合的多模态MSI检测
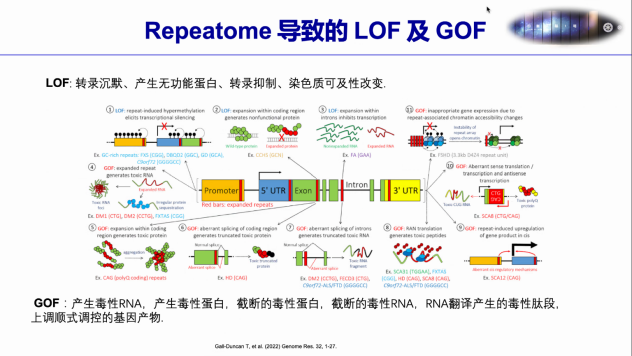
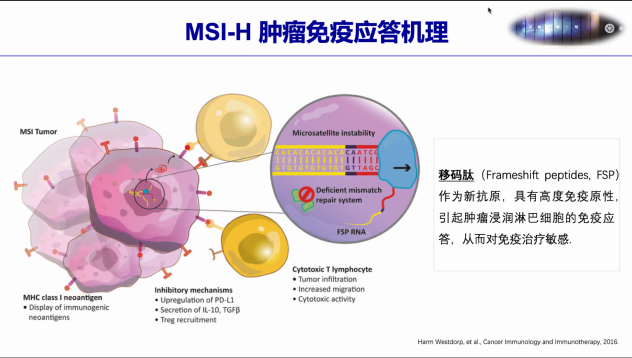
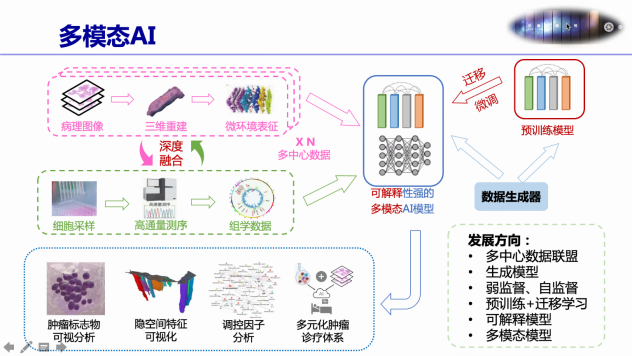
通常MMR 蛋白功能异常会导致微卫星(MS)发生deletion或者insertion,造成微卫星不稳定(MSI),其中MSI-H肿瘤常发生于结直肠、子宫内膜和胃等部位。MSI-H型肿瘤中会产生大量的移码突变,造成移码肽(FSP)的产生,这些移码肽作为新抗原,具有高度免疫原性,从而对免疫治疗更加敏感。 MSIsensor是首个基于NGS数据检测癌症基因组微卫星不稳定性(MSI)的算法,在MSIsensor的基础上,结合机器学习模型,持续研发了基于单肿瘤组织和外周血游离DNA(cfDNA)测序数据的MSI状态检测算法MSIsensor2与MSIsensor-ct。目前,MSIsensor系列算法被超过700多个临床研究项目所广泛应用,为国际上引用数最高的泛癌种NGS-MSI探测工具集。 根据肿瘤HE染色组织切片图像分割,结合多组学数据,通过学习算法,深度融合人工智能,基于多模态AI模型预测微卫星不稳定性(MSI)的状态,这是求臻医学不断探索研究的领域,通过对更大数据集的训练和前瞻性验证,最终能够有效地识别MSI肿瘤患者,使癌症免疫治疗惠及广泛的目标人群。 part/2 讨论环节

1 ADC药物的靶点往往分布广泛,比如Trop2、Nectin4是否在ADC联用免疫的试验中仅需要关注免疫治疗的biomarker? 在ADC联用免疫治疗的临床试验中,需要全面评估适应症靶点分布是否广泛、对照组药物、ADC和免疫治疗的协同作用、临床试验研究策略等,全方位地评估ADC和免疫治疗两种疗法的联合应用,以确保试验的安全性和有效性。 2 请以预测性标志物为例,探索多少例患者可以确定标志物的阈值? 根据CDE发布的《晚期结直肠癌新药临床实验设计指导原则》,探索性研究需要合适的样本量为后期关键研究提供依据。通常在开展关键研究前,非生物标志物富集的人群中期望获得50-60例的探索性的数据,而在生物标志物富集人群中获得20-30例的探索性数据。对于特别罕见的生物标志物富集人群,药物治疗靶点明确,样本量可基于疾病特征和药物机制进行估算。鼓励申请人在开展关键研究前,就已获得的研究结果与监管部门沟通。 3 MSI目前都是通过PCR方法获批的,多久能够实现通过其它方法获批MSI的检测呢? 目前,以其它方法检测MSI的技术仍面临一些挑战和问题,MSI结果的量化、MSI结果与患者治疗获益之间的相关性等仍需要大量临床试验数据验证进行进一步探索,尤其是对MSI相关机制的研究,还需要更多的时间。当然,测序技术是需要被认可的,并不仅仅因为它具有更多位点数量,而是因为与PCR平台相比这两种技术可以相互补充。求臻医学将继续秉承“开放、合作、创新、共赢”的理念,不断深化其它技术在抗肿瘤免疫药物Biomaker研发中的应用,促进学术交流与合作,共同推动抗肿瘤免疫药物开发,为患者带来更多的希望与福音。 《臻享会》系列线上会议将持续开展,可关注求臻医学公众号获取更多信息或扫描左侧二维码进行回放观看。

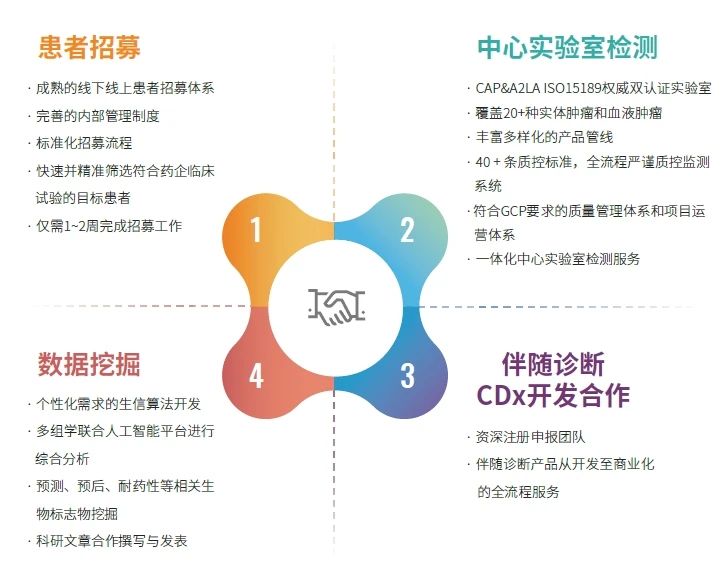
求臻医学药企合作
求臻医学药企合作在患者招募、中心实验室检测、伴随诊断开发合作以及数据挖掘的多领域高效助力医药企业推进临床研究进展。 如您对相关项目感兴趣,请联系求臻医学药企合作部:010-56380035