摘要
转移性结直肠癌(mCRC)治疗仍以含氟脲嘧啶联合奥沙利铂/或伊立替康的化疗方案作为基础。FOLFIRI方案中伊立替康的推荐剂量为180 mg/m2,既往有研究结果显示该推荐剂量远低于UGT1A1*1/*1和*1/*28基因型患者的耐受剂量;所以临床阶段有必要依据UGT1A1基因的分型而对mCRC患者的伊立替康剂量进行提升而在不显著增加毒性反应的前提下获得更好的疗效及预后。本研究通过明确治疗前的UGT1A1基因分型,指导mCRC患者一线使用增量FOLFIRI+贝伐珠单抗治疗,结果表明对于UGT1A1*1/*1和UGT1A1*1/*28基因型的mCRC患者,高剂量的伊立替康方案可以为患者带来客观缓解率、疾病控制率及无进展生存期(独立于患者KRAS基因状态)的显著获益,且不良反应发生率较接受常规剂量的对照组并无差异。因此临床实践中非常有必要依据患者UGT1A1基因分型而选择性提升伊立替康剂量,进而获得更佳的治疗结局。
研究背景
伊立替康在体内经羧酸酯酶代谢为活性产物SN-38(7-乙基-10-羟基喜树碱),随后主要通过UGT1A1同工酶失活。UGT1A1是一种多态性酶,其启动子区的TA重复数与基因转录效率和整体酶活性呈负相关。既往研究中显示,UGT1A1多态性与伊立替康治疗mCRC患者的毒性相关,如骨髓抑制和严重腹泻。虽然伊立替康代谢不单纯依赖UGT1A1多态性,但基因组检测确可作为鉴别有更高伊立替康治疗毒性风险患者的选择,因此基于UGT1A1基因型进行个体化的治疗,以期优化治疗疗效和耐受性。
研究方法
对照组患者进行常规双周FOLFIRI+贝伐珠单抗治疗,不行UGT1A1基因分型;研究组采用相同治疗方案,但根据UGT1A1基因分型对伊立替康进行剂量增加。主要终点为无进展生存(PFS),次要终点为总的治疗反应率(ORR)、疾病控制率(DCR)、总生存(OS)、不良反应(AEs)和转移灶切除率。
研究结果
中位随访26.0个月(IQR,17.0-35.0个月),研究组(n=107)在PFS、OS、ORR、DCR和转移切除率方面均优于对照组(n=106)(P<0.05)(图1)。虽然研究组伊立替康的相对剂量强度增加了1.36倍,但两组的≥3级AEs并无显著性差异,伊立替康剂量增加是ORR(P<0.001)和DCR(p=0.006)的独立因素,可改善KRAS野生型和突变型mCRC患者的PFS(p=0.007和p=0.019)(图2和图3)。

图1 213例mCRC患者,研究组PFS(A)和OS(B)优于对照组

图2 112例野生型KRAS mCRC患者,研究组PFS(A)优于对照组,OS(B)无显著性差异
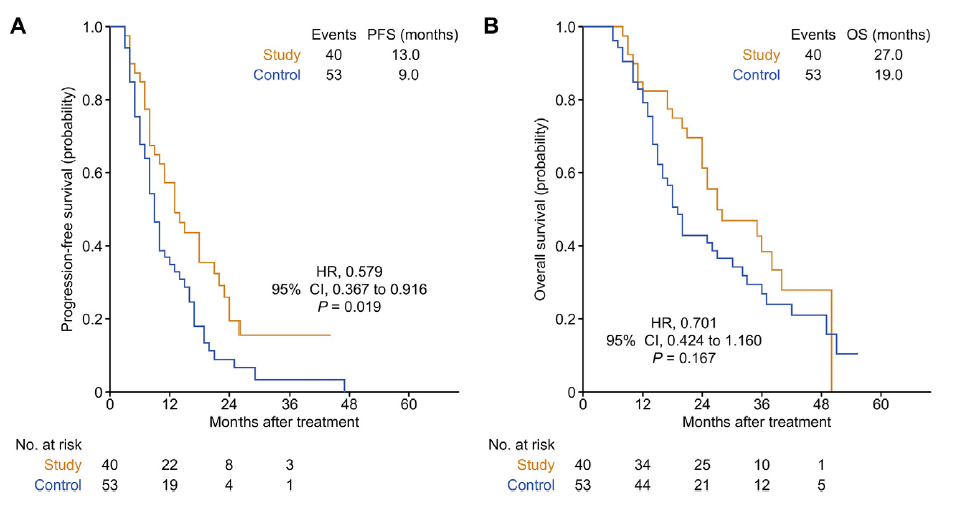
图3 93例KRAS突变的mCRC患者,研究组PFS(A)优于对照组,OS(B)无显著性差异
讨论
这项根据UGT1A1基因分型指导伊立替康剂量增加的研究有如下发现:(1)伊立替康剂量增加利于PFS和OS;(2)剂量增加是独立影响ORR和DCR的因素;(3)无论KRAS基因分型,伊立替康剂量增加显著改善PFS;(4)伊立替康剂量增加联合贝伐珠单抗治疗不增加严重AEs、结肠穿孔或出血的发生率。ITT分析表明,在UGT1A1基因分型指导下,伊立替康剂量增加有更多的治疗获益。
CRC具有肿瘤间和肿瘤内的异质性。过去20年中,靶向药物与细胞毒性化疗方案的联合使得mCRC的中位OS超过40个月。既往研究中使用贝伐单抗联合伊立替康或奥沙利铂为主的方案作为mCRC的一线治疗,但治疗结果并不完全一致,这种不一致性可能是由于UGT1A1多态性导致伊立替康治疗疗效低下所致。FIRE-3和CALGB/SWOG 80405两项大型研究显示中位PFS和OS分别为10.3个月、25.0个月和10.6个月、29.0个月。这项研究显示,伊立替康剂量增加患者的中位PFS为14.0个月,OS为30.0个月,充分表明了治疗前UGT1A1基因分型指导的mCRC伊立替康剂量可以带来疗效的提升。
不同研究显示,化疗+贝伐珠单抗治疗后的可切除率为11.8%-51%。Folprecht等发现,特定人群中治疗反应率与转移灶切除术间具有相关性。对于转移性疾病患者,2016 ESMO指南推荐,最有效的治疗方案应基于临床治疗反应。FIRE-3和CALGB/SWOG80405研究中的ORRs分别为58.0%和55.2%。一项II期研究显示高剂量伊立替康治疗的患者有更好的ORR,为67.5%,与这项研究结果相似,即伊立替康剂量增加患者较对照组患者有更好的ORR(71.9%)和转移灶切除率(31.8%)。
既往报告显示,UGT1A1*28基因型与伊立替康诱导的毒性之间存在剂量依赖性关系,UGT1A1*28基因分型可用于指导治疗以减少剂量限制性中性粒细胞减少且不影响疗效。Shulman等亦报告,伊立替康治疗患者时,UGT1A1*28基因型与严重血液学毒性和较差生存密切






