摘要
在西方肺腺癌患者中KRAS突变率达20%~25%,其中KRAS G12C是原发性肺腺癌中最常见的KRAS突变亚型。I期临床试验表明KRAS G12C抑制剂在晚期肿瘤中具有显著疗效。本研究对KRAS G12C突变原发性肺腺癌(LUAD)患者术后的无病生存率(DFS)和肿瘤基因组特征进行探索性分析。发现KRAS G12C突变与I-III期LUAD根治术后较差的DFS相关。KRAS G12C突变肿瘤较其他类型KRAS突变肿瘤在临床病理学及基因组特征方面侵袭性更强,提示这类高危人群可能从KRAS G12C抑制剂治疗中获益,从而延长生存期,该研究为KRAS G12C抑制剂应用于早期LUAD辅助治疗奠定临床基础与理论依据。同时也提示临床阶段应加强对KRAS G12C肺腺癌患者的术后随访,以助于及早发现复发及制定对应治疗策略,延长患者生存。
研究方法
研究纳入纪念斯隆·凯特林癌症中心自2010年2月至2018年12月中R0切除术后、病理为I-III期的LUAD患者,确诊后进行二代测序(NGS)。排除接受诱导治疗、非根治性切除及低质量NGS检测患者。根据原发肿瘤的KRAS突变状态,分为KRAS野生型(KRAS WT)、G12C突变型(KRASG12C)或其他突变型(KRAS other)。应用MSK-IMPACT进行肿瘤基因组图谱分析、TMB和FGA分析。
研究结果
临床病理学特征
患者KRAS状态如下:374 例KRAS WT(62%)、95例KRAS G12C (16%)、135例KRAS other (22%)。手术时平均年龄为68岁,67%患者为女性。77%患者有吸烟史,平均27包/年。与KRAS WT相比,KRAS突变LUAD患者通常有吸烟史。214例(35%)患者进行亚肺叶切除。I期、II期、III期患者比例分别为74%、16%、10%。值得注意的是,与KRAS WT患者相比,KRAS突变(无论类型)患者PD-L1表达较高(p = 0.013),通常≥50%。术后19%患者进行辅助治疗,包括单纯化疗、放化疗、仅放疗。中位随访时间为2.51年。

与DFS相关的临床病理学因素
在单因素分析中,多种因素均与DFS相关:一氧化碳在肺部的扩散能力(DLCO)、原发性肿瘤最大标准摄取值、开胸手术、肿瘤大小、脉管侵犯(LVI)、脏层胸膜受侵(VPI)、肿瘤气道播散(STAS)、微乳头状或实性组织学亚型、淋巴结转移、LUAD II-III期、KRAS G12C突变、TMB、以及片段基因组改变(FGA)。多变量分析中,KRAS G12C与较差的DFS呈独立相关(p=0.046)。此外,DLCO、LVI、VPI、STAS、病理分期II-III期均与较差的DFS相关。
KRAS G12C与KRAS other的临床病理学/基因组学差异
对两组间最常见的10个突变基因进行比较(图2)。发现尽管无统计学差异,但KRAS G12C肿瘤中STK11基因及NF1基因突变较多。KRAS other肿瘤中RBM10基因突变率是另一组的2倍。
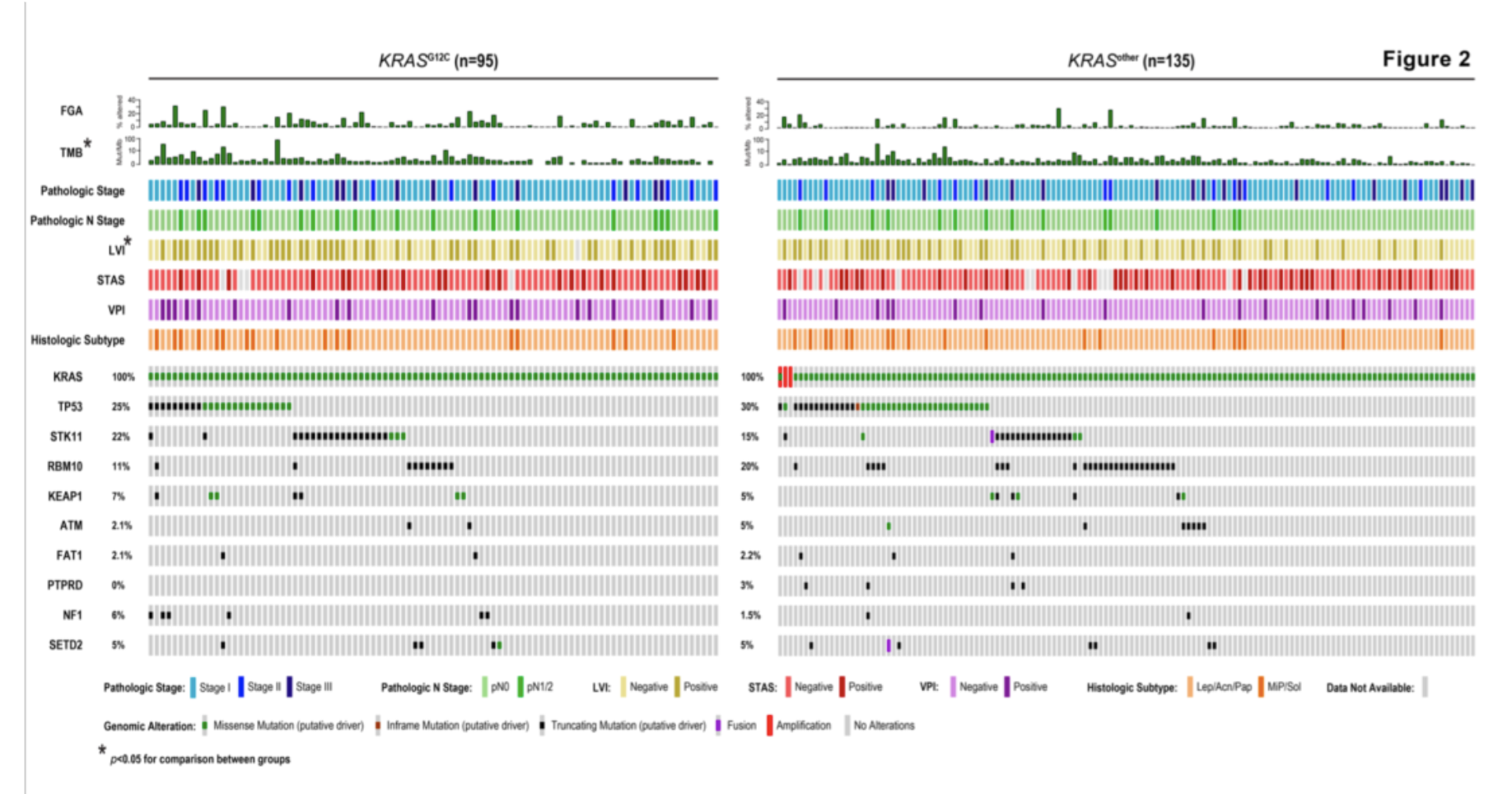
图2. KRAS G12C与KRAS other的临床病理学/基因组学差异
与DFS相关的基因
总体人群中,TP53基因、RBM10基因与DFS相关。KRAS G12C患者中,并无基因与DFS相关。
基因共存与互斥模式
总体人群中,STK11及KEAP1基因显著共存。任何KRAS突变与均与RAS通路上其他基因(EGFR基因、BRAF基因、MET基因)呈互斥模式。未发现基因与KRAS G12C或KRAS other显著共存。在KRAS G12C肿瘤中,TP53和NF1突变呈显著共存。KRAS G12C肿瘤中,再次发现STK11及KEAP1基因显著共存。
KRAS突变肿瘤的克隆模式及体系突变特征

图3. KRAS突变肿瘤的体系突变特征
DFS的验证
对476例来自TCGA、未进行诱导治疗的I-III期LUAD患者进行分析并验证上述结论。结果发现,任何类型的KRAS突变患者及KRASwt患者的3年DFS无差异(图4A)。但KRAS突变患者中,KRAS G12C的3年DFS显著劣于KRAS other(31.3% vs 54.2%,p=0.007)(图4B)。从而进一步证实本研究中KRAS G12C突变与DFS的关联。

图4. A:经TCGA验证后KRAS突变型、野生型的DFS; B:经TCGA验证后KRAS G12C、KRAS other的DFS
讨论
本研究的局限性包括早期患者死亡事件较少,因此无法将OS作研究终点。亚洲LUAD患者KRAS突变率较低,本研究结论需要进一步来自亚洲的数据来验证。
点评
KRAS G12C突变是肺癌中最常见的KRAS突变,是I-III期LUAD完全切除后不良DFS的独立预后因素。对KRAS突变状态的检测可预测早期LUAD患者的复发风险。联合TMB检测及体细胞突变检测,可能预测免疫治疗的疗效。本研究为KRAS G12C抑制剂应用于早期疾病提供依据,为KRAS G12C抑制剂应用于早期LUAD的辅助治疗奠定临床基础。
KRAS G12C Mutation Is Associated with Increased Risk of Recurrence in Surgically Resected Lung Adenocarcinoma. Clin Cancer Res. Feb 2021.






