近年来,随着免疫治疗的快速发展,肿瘤免疫治疗的研究进展突飞猛进。免疫检查点抑制剂 (如PD-1/PD-L1单抗) 在不同类型的恶性肿瘤治疗中展现出了显著的疗效和巨大的应用前景。那么,临床上针对不同的癌种应如何正确有效地实施抗PD-1/PD-L1免疫治疗呢?这有赖于免疫治疗相关生物学标志物(biomarker)的筛选,基于免疫治疗biomarker的检测能更加精准的指导肿瘤的免疫治疗。因此,本文特针对免疫检查点抑制剂的biomarker进行简述。
PD-1/PD-L1抑制剂的biomarkers
目前的研究结果,普遍认为与抗PD-1/PD-L1免疫治疗的疗效相关的biomarkers主要包括以下几种:
(1)肿瘤组织PD-L1蛋白的表达水平;
(2)肿瘤突变负荷(Tumor mutational burden,TMB);
(3)错配修复蛋白/基因缺陷/微卫星高度不稳定(dMMR/MSI-H);
(4)致癌驱动突变和其它免疫正负相关基因变异;
(5)其它......
目前多项重要研究也证实了biomarkers与免疫治疗的疗效存在密切的关联(详见图1)。
图片

图1 biomarkers与免疫治疗的疗效的关联
免疫治疗相关biomarkers的研究进展
(1)肿瘤组织PD-L1蛋白表达水平
PD-L1称之为“程序性死亡蛋白配体-1”,它在肿瘤细胞表面可选择性地高表达,并通过与激活的T细胞表面的PD-1特异性结合活化PD-1/PD-L1下游通路,传递负性调节信号,从而促进T细胞的凋亡并导致其免疫活性丧失。
Topalian教授等在NEJM杂志上发表的一项研究表明,在不同的肿瘤类型中,肿瘤组织PD-L1的表达水平通常与PD-1/PD-L1抑制剂治疗的应答率呈现出较显著的正相关性。
该研究中,在接受PD-1单抗治疗的42例患者中,PD-L1阳性的25例患者中有9例对免疫治疗客观响应,而PD-L1阴性的17例患者则无客观响应。
由此可见,PD-L1表达状态与PD-1单抗治疗的疗效具有一定的正相关性(详见图2)。

图2 PD-L1表达状态与PD-1单抗治疗的疗效
此外,在一项纳武利尤单抗(Nivolumab)治疗鳞状非小细胞肺癌(NSCLC)的II期、单臂临床试验中,应用抗人PD-L1抗体对肿瘤组织进行免疫组织化学染色(IHC),将阳性阈值定义为IHC≥5%(肿瘤细胞百分比),结果显示,PD-L1阳性组和PD-L1阴性组的客观缓解率分别为24%和14%。这项研究也在一定程度上说明了,PD-L1阳性可能是PD-1单抗治疗的适应症和利好因素之一。
此外,值得特别强调的是,基于 Keynote-024研究结果,FDA批准了肿瘤组织PD-L1表达作水平作为PD-1单抗治疗转移性NSCLC的伴随诊断方法,且阳性阈值定义为IHC≥50%。
(2)肿瘤突变负荷(TMB)
肿瘤突变负荷(TMB)是一类定量的生物学标志物,它是肿瘤基因组中平均每百万个碱基(1Mb)范围内所含非同义体细胞突变的数量,反映了每百万碱基中被检测出的体细胞基因编码错误、碱基替换、基因插入或缺失等错误的总数。目前已有多项研究证实,TMB高的患者具有更好的免疫治疗效果,可作为预测免疫治疗效果的又一重要生物学标志物。
Johnson等对晚期黑色素瘤患者的肿瘤标本进行了二代测序,其结果显示:
a. 对PD-1单抗治疗有效的患者通常具有更高的TMB(详见图3的A和B)
b. 高TMB患者的无进展生存期(PFS)和总生存时间(OS)均优于中或低TMB的患者(详见图3的C和D)。
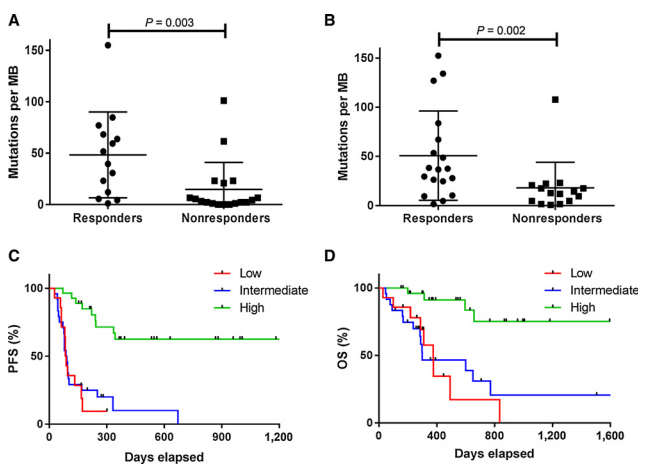
图3 队列中有应答与无应答的突变负荷
此外,Peters等的研究对比了纳武利尤单抗和含铂双药一线治疗 NSCLC患者的疗效,结果发现纳武利尤单抗组对高TMB患者的客观响应率(ORR)和PFS改善明显。
综上,基于多项研究,我们认为高TMB在各种肿瘤类型中较为常见,且与抗PD-1/PD-L1单抗治疗的疗效密切相关。通常来说,TMB越高、新生抗原数量越多,肿瘤免疫原性则越强,免疫检查点阻断治疗疗效越显著。
(3)错配修复缺陷/微卫星高度不稳定
微卫星不稳定性(MSI)是指DNA甲基化或基因突变致错配修复(MMR)基因缺失,从而导致微卫星重复序列长度的改变,因此MMR基因缺陷(dMMR)即被认为高度微卫星不稳定(MSI-H)。
研究表明,dMMR或MSI-H导致突变的积累,可以产生新抗原,而体细胞突变所产生的新抗原可作为抗肿瘤继发免疫反应的首要驱动因素。也就是说dMMR或MSI-H能够从PD-1/PD-L1抑制剂治疗中获益。
Le等发表在NEJM杂志上的一项研究,报道了41例结直肠癌(CRC)患者接受PD-1单抗治疗的结果,结果显示:
a. 11例dMMR的患者,其PFS和OS均明显优于21例pMMR的患者(详见图4A和B);
b. 常规治疗失败的MSI-H患者对PD-1单抗治疗出现了显著的应答。其疗效及生存情况显著优于无MMR或MSI-H的患者。MMR缺陷的CRC患者组、MMR缺陷的非CRC患者组、无MMR缺陷的CRC患者组客观响应率(ORR)分别为40%、71%及0%;免疫相关无进展生存率(PFS)分别为78%、67%及11%。

图4 根据错配修复状况分析帕博利珠单抗治疗的临床疗效
从此,一个新兴的预测免疫治疗疗效的生物学指标进入了人们的视野。
2017年,抗PD-1单抗帕博利珠单抗和纳武利尤单抗相继获批用于dMMR/MSI-H的转移性结直肠癌(mCRC)患者,此外,多项研究表明dMMR/MSI-H晚期实体瘤患者对于PD-1/PD-L1抗体等免疫检查点抑制剂(ICI)有较高的应答率,且与癌种无关,这表明MMR/MSI-H可以作为免疫治疗疗效的重要预测因子。
(4)致癌驱动突变和其他免疫正负向基因变异
目前研究表明,特定的基因变异也与PD-1单抗等免疫治疗的疗效相关,也可能是其疗效评价的潜在标记物。
其中,某些免疫正负向基因在疗效评估中的价值已经初步证实(如图5):
a. EGFR突变患者接受PD-1/PD-L1治疗的疗效要差于EGFR野生型患者,因为EGFR突变能够使PD-L1上调,并阻碍肿瘤浸润淋巴细胞(TILs)的活性,并且EGFR突变与低的TMB及弱的肿瘤特异性免疫反应相关;
b. 与EGFR突变相反,KRAS突变更易从PD-1/PD-L1抑制剂中获益,且KRAS与TP53共突变常伴随有TMB高表达。ALK融合阳性与低密度的CD8+TIL和PD-L1的下调有关;
c. MDM2/4扩增是进展期NSCLC免疫治疗超进展的潜在分子标志物。

图5 肿瘤免疫治疗正负相关biomarker
除了上述比较明确的biomarker以外,更多免疫biomarker也正在探索中,未来期待更深的研究。
小结
1.PD-1/PD-L1抑制剂在部分种类的恶性肿瘤的治疗中取得了显著的成功,但仍有很多癌种缺乏相应的biomarker来细分筛选免疫获益人群,开发可靠的biomarker来监测免疫治疗的反应,是肿瘤精准免疫治疗发展的方向。
2.基于目前的研究探索结果而言,PD-L1高表达、TMB高、dMMR/MSI-H这几大biomarkers提示PD-1单抗治疗可能会获得良好的疗效,并获批了相应的癌种和适应症,得到指南和专家共识的推荐。
3.另外,致癌驱动基因变异和其他免疫正负向因子在免疫治疗疗效预测中的价值也不断被挖掘,未来可期。
4.欲建立强有力的疗效预测biomarkers体系,未来需要在多学科、多方共识的基础上,进行更深一步的探索性研究。
求臻医学ChosenOne599®泛癌种基因检测产品,可检测599个与中国人群肿瘤精准用药、预后、遗传易感风险相关的基因,同时配套赠送一种PD-L1抗体的检测,对PD-L1蛋白表达、MSI/dMMR、TMB(被纳入《结直肠癌分子检测高通量测序专家共识》)、免疫治疗正负向相关基因以及其他免疫治疗标志物进行全面的检测,可有效评估免疫治疗的疗效,为免疫治疗人群提供更全面可靠的信息。
参考文献:
[1] Topalian SL, et al. Safety, activity, and immune correlates of anti-PD-1 antibody in cancer. N Engl J Med 2012 Jun 28;366(26)
[2] Reck M,et al.Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer. N Engl J Med. 2016 Nov 10;375(19):1823-1833.
[3] Reck M,et al. Five-Year Outcomes With Pembrolizumab Versus Chemotherapy for Metastatic Non-Small-Cell Lung Cancer With PD-L1 Tumor Proportion Score ≥ 50.J Clin Oncol 2021 Apr 19
[4] Johnson DB ,et al. Targeted Next Generation Sequencing Identifies Markers of Response to PD-1 Blockade.Cancer Immunol Res. 2016 Nov;4(11):959-967.
[5] Hellmann MD,et al.Nivolumab plus Ipilimumab in Lung Cancer with a High Tumor Mutational Burden.N Engl J Med. 2018 May 31;378(22):2093-2104
[6] Biedrzycki B,et al. PD-1 Blockade in Tumors with Mismatch-Repair Deficiency.N Engl J Med. 2015 Jun 25;372(26):2509-20.
[7] Overman MJ, McDermott R, Leach JL, et al. Nivolumab in patients with metastatic DNA mismatch repair deficient/microsatellite instability-high colorectal cancer (CheckMate 142): results of an open-label, multicenter, phase 2 study [J]. Lancet Oncology, 2017,18(9):1182-1191.
[8] Le DT, Uram JN, Wang H, et al. PD-1 blockade in tumors with mismatch-repair deficiency [J]. N Engl J Med. 2015; 372(26): 2509-2520.
[9] Marabelle A, Le DT, Ascierto PA, et al. Efficacy of Pembrolizumab in Patients With Noncolorectal High Microsatellite Instability/Mismatch Repair-Deficient Cancer: Results From the Phase II KEYNOTE-158 Study [J]. J Clin Oncol. 2020; 38(1): 1-10.
[10] Le DT, Durham JN, Smith KN, et al. Mismatch repair deficiency predicts response of solid tumors to PD-1 blockade [J]. Science. 2017; 357(6349): 409-413.
[11] 结直肠癌分子检测高通量测序中国专家共识. 临床肿瘤学杂志 2021;26(3):253-264






