目前临床阶段仅对已经表现出遗传性肿瘤综合征特征的胃食管肿瘤患者推荐进行胚系基因筛查,而临床学界一直在探寻更广泛的基因检测是否可能发现更多的胚系突变患者。本研究通过检测胃食管肿瘤患者的可能致病或致病性(LP/P)胚系突变,发现胃癌及早期胃食管癌患者中高-中外显率的LP/P胚系突变频率更高,尤其是高外显率的LP/P胚系突变,在不同肿瘤部位中的差异更大,胃癌中高达10.3%,食管癌中仅为1.9%,且具有统计学意义(P=0.001),最常见的高-中外显率的LP/P胚系突变为BRCA1/2 (14 [2.7%]),ATM (11 [2.1%]),CDH1 (6 [1.2%])和MSH2 (4 [0.8%])。76.4%(42/55)的患者根据现有指南推荐会存在漏检,这其中有55.2%(16/29)的患者存在高-中外显率的胚系突变,提示临床阶段应充分重视对肿瘤患者胚系致病性突变的检测,这不仅可以改善患者的个体化治疗方案和生存率,还有助于家族成员的防癌控癌,切实为患者及家属带来临床获益。
研 究 背 景
胃食管癌是全球最常见肿瘤之一。尽管多数病例为散发性,但有部分胃癌与遗传性癌症易感综合征相关,特别是遗传性弥漫性胃癌、遗传性乳腺癌和卵巢癌和Lynch综合征。但由于仅对存在遗传综合征患者进行常规基因检测,目前胃食管癌患者中致病的胚系基因突变发生率尚不明确。
研 究 方 法
回顾性分析了2014年1月至2019年12月斯隆-凯特琳纪念肿瘤中心收治的515名胃食管癌患者的临床与测序数据,这些患者应用MSK-IMPACT对其肿瘤组织及配对血进行胚系DNA突变检测,血液中正常非肿瘤DNA应用76或88基因panel分析(包含ACMG指南提到的所有癌症易感基因)。胚系突变分为高外显率(相对风险,>4)、中外显率(相对风险,2-4)、低外显率(相对风险,<2)及意义未明或隐性。一旦患者检出胚系可能致病或致病(likely pathogenic or pathogenic ,LP/P)突变,则需要接受遗传咨询。
研 究 结 果
患者及疾病特征
研究共纳入515例患者(表1)。501例(97.3%)患者为腺癌,344例(6.8%)患者诊断时即为晚期已经有转移。478例(92.8%)患者初始治疗为含铂方案。
表1. 研究人群的人口学及病理生理学特征。

胚系突变
515名患者中, 161例(31.3%)患者为食管癌,111例(21.6%)患者为胃食管结合部癌(GEJ),243例(47.2%)患者为胃癌。LP/P胚系突变与肿瘤位置之间存在临界关联(食管癌,17 [10.6%]; 95% CI,6.3%-15.4%; 胃食管结合部癌,16 [14.4%]; 95% CI, 8.5%-22.3%; 胃癌48 [19.8%];95% CI, 14.9%-25.3% ;P=0.04,图1)。由于胃食管结合部癌在临床上很难界定是真正的胃食管结合部癌还是近端胃癌或远端食管癌,所以只对胃癌和食管癌数据进行对比分析。与食管癌患者相比,胃癌患者胚系突变率更高(19.8% VS 10.6%,P=0.02)。
对基因突变外显率及其与肿瘤部位分布的分析发现,与食管癌患者相比,胃癌中LP/P高-中外显率基因突变率显著升高(11.9% VS 5.0%,P=0.03)(图1)。胃癌中LP/P高外显率发生比率最高为10.3%,其次是食管癌1.9%,最低的为胃食管结合部癌仅有1.9%。中外显率、低外显率、单等位基因常染色体隐性及不确定基因突变率在三种肿瘤中无统计学差异,这与这些突变是偶发的与肿瘤发展无关的假设相吻合。

图1. 不同肿瘤部位的体系突变外显率百分比。
根据肿瘤部位分层分析后发现,早发(初诊年龄≤50岁)肿瘤患者中的胚系突变率高于初诊年龄>50岁的肿瘤,但无统计学差异,可能由于每个亚组中早发肿瘤患者入组样本较少所致。
图2及图3展示了根据外显率观察到的胚系LP/P突变谱。LP/P突变发生于15个高/中外显率基因,最常见的为ATM、BRCA1、BRCA2、CDH1、MSH2。ATM为最常见的单基因突变,发生率为2.1%。

图2. 高-中外显率分布。

图3. 低外显率、不确定或隐性基因外显率分布。
高频遗传性基因突变
根据ACMG指南,76.4%(42/55)的患者可能遗漏胚系突变检测,其中包括55.2%(16/29)的高-中外显率突变。
6例早发肿瘤患者(2例胃癌,1例胃食管结合部癌,3例食管癌)存在ATM LP/P突变,其中3例患者存在胃癌家族史。图4为一例携带ATM突变的胃癌患者家系图,先证者在29岁时即诊断为胃癌。

图4. ATM致病性突变患者系谱。
BRCA1及BRCA2突变率各为1.4%。14例BRCA1/2 LP/P携带者中,8例存在家族史,7例符合遗传性乳腺癌及卵巢癌综合征的诊断标准。图5为一例携带BRCA2突变的早发胃癌患者家系图。肿瘤测序提示存在BRCA2体系突变,符合二次打击学说,表明胚系突变事件可能是肿瘤发生的驱动因素。
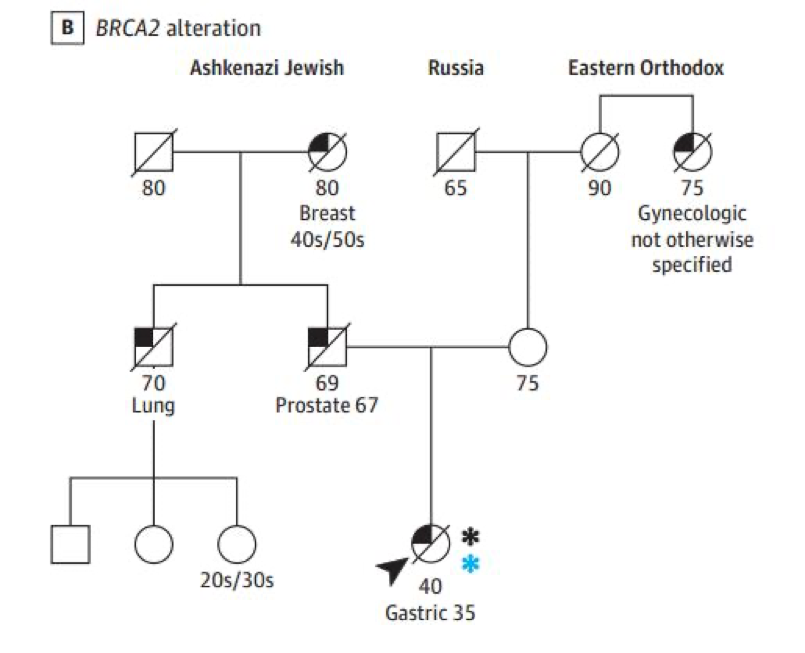
图5. BRCA突变患者系谱(蓝色星标代表存在体细胞突变)。
6例胃癌患者中存在CDH1 LP/P突变。图6显示一例携带CDH1胚系致病性突变胃印戒细胞腺癌患者的家系图,该患者虽然不符合CDH1胚系分析的临床标准,但却检出胚系致病性突变,推测可能遗传自父系血统,且无遗传性弥漫性胃癌家族史。

图6. CDH1胚系突变患者系谱(粉色星标代表肯定携带者,黄色星标代表肯定胚系突变阴性)。
与治疗疗效的相关性
评估HRD及DDR基因突变是否会影响患者接受含铂化疗的疗效及预后,发现HRD、DDR、其他胚系突变或无胚系突变患者的12月OS及PFS率均无差异。有/无BRCA1/2胚系突变患者的PFS及OS亦无差异,可能与样本数较少相关。
讨 论
本研究发现,与食管癌相比,胃癌的胚系致病性突变频率更高,且高外显率的基因突变率高达食管癌的5倍(10% vs 2%)。
与既往研究结果相似,约2%患者发生中度外显率的ATM基因突变。尽管ATM胚系突变与乳腺癌及胰腺癌患病风险增加有关,但其与胃食管癌的关系尚不明确。85.7% BRCA1/2携带者为胃癌或GEJ肿瘤患者,表明BRCA在胃癌发生中发挥了潜在作用,图2中的例子也提示BRCA2胚系突变与肿瘤发生可能有关。FDA批准PARP抑制剂用于携带BRCA突变的卵巢癌、乳腺癌、前列腺癌和胰腺癌,检测胚系BRCA1/2突变可能有助于推动PARP抑制剂在胃食管癌中开展研究应用。
约76.4%的患者无个人患癌史或癌症家族史,遵照NCCN指南和ACMG指南无需进行基基因检测,但这其中却有55.2%患者存在高或中外显率的基因突变。提示根据临床指南进行筛查的敏感性低,本研究提示所有胃癌患者在接受体系肿瘤基因检测的同时都应进行胚系基因检测,鉴别临床可治疗的突变对于有风险的家族成员具有明确的筛查和指导意义。但高外显率胚系突变在食管癌中比例不高,仅占2%,不足以说明在此类患者中进行常规胚系基因检测的合理性。GEJ肿瘤患者高外显率胚系突变率(4.5%)介于食管癌和胃癌之间,且如何对这类肿瘤进行精准分类,是归于食管癌还是胃癌在临床上挑战极大,因此可考虑对GEJ肿瘤患者进行胚系基因检测。
本研究生存分析显示携带HRD及DDR信号通路胚系突变的患者,尤其是BRCA1/2基因突变的患者接受铂类化疗后并未提高治疗反应率。此结论与既往胰腺癌相关结果相悖,可能由于样本数不足以得出生存差异的结论。研究中仅5例BRCA1/2突变晚期胃食管癌患者接受一线含铂方案治疗。中位DFS为13.7个月,优于既往化疗结果(4-6个月)。此外,并非所有BRCA胚系突变都会导致这些肿瘤发生,且把三个瘤种放在一起分析可能掩盖了BRCA的潜在差异效应。同时,由于无法评估这些个体的体系BRCA突变和杂合性缺失情况, 所以无法明确BRCA胚系突变的作用。
点 评
本大型回顾性分析研究证实约有10.3%的胃癌及1.9%的食管癌患者可以检出胚系致病性基因突变,且如果仅依照NCCN或ACMG指南对高危人群筛查,会有76.4%(42/55患者)存在胚系突变的患者漏检。本研究结果提示对于胃癌、胃食管结合部肿瘤,尤其是早发胃食管癌患者进行胚系基因检测很有必要,可有效鉴别肿瘤易感人群及家族、有助于降低亲属患癌风险、早诊早治,并且有利于各种微创治疗方案的及早选择,得到根治。
求臻医学ChosenOne599®
全面覆盖多个罕见驱动突变基因
肿瘤患者的胚系遗传背景与肿瘤的发生发展、治疗以及预后等息息相关。对于胃癌、食管癌等消化系统肿瘤,胚系致病或可能致病基因的检出显得尤为重要。ChosenOne599®涵盖了127个和肿瘤遗传易感相关的基因,通过对患者肿瘤组织和对照样本的分析,可以准确区分体系和胚系变异。这一方面可以提示患者及亲属的家族遗传风险,另一方面还可指导PARPi(BRCA1/2等HRR基因)、ICIs(MMR基因及ATM等DDR通路相关基因)以及化疗等综合治疗。






