臻知识·专家访谈 | 第07期

晚期NSCLC中EML4-ALK基因融合发生率约为3%-5%,布加替尼虽是指南推荐的二线治疗的药物,但布加替尼一线治疗EML4-ALK变体及TP53突变的治疗数据值得关注。求臻医学特邀首都医科大学附属北京朝阳医院呼吸与危重症医学科王峰教授,结合最新发布于Journal of Thoracic Oncology上的一篇文章进行解读。
王峰教授:在一线治疗ALK阳性NSCLC的III期ALTA-1L研究中,布加替尼疗效优于克唑替尼。与此同时,布加替尼对大多数ALK继发性耐药突变也有疗效。目前已发现15种EML4-ALK融合变体,常见的为V1、V2和V3,已有证据表明,变体状态可能影响治疗效果和导致ALK抑制剂的获得性耐药。除此之外,TP53基因的共突变也会对治疗效果产生负面影响。但是,关于ALK抑制剂治疗EML4-ALK变体及TP53突变的数据非常有限,尤其是在一线治疗中。
本文中的ALTA-1L研究,入组275例患者随机分入布加替尼组或克唑替尼组,3年PFS率分别为43%、19%。中位OS尚未达到。由于后续抗肿瘤治疗不均衡(包括交叉入组、克唑替尼组停药后接受后续治疗比例较高)等因素影响,两组OS结果相似。布加替尼持续发挥强大的颅内抗肿瘤作用,降低所有患者56%的颅内进展风险,及71%脑转移患者颅内进展风险。颅内疗效可长期持续,布加替尼组中位颅内DOR达27.9个月,克唑替尼仅为9.2个月。尽管克唑替尼组患者交叉入组比例较高,基线脑转移患者应用布加替尼OS的HR为0.43,表明脑转移患者一线ALK-TKI应用布加替尼可提高生存获益。布加替尼在颅内的高应答率及DOR时间为后续研究中的最佳药物顺序提供了理论依据。
与既往研究结果相一致,血浆中EML4-ALK融合变体以V1及V3为主导。布加替尼在V1、V2、V3变体中的疗效均优于克唑替尼。与V1变体相比,V3患者无论布加替尼或克唑替尼治疗,PFS均呈明显缩短(P=0.002),且V3亚型后续更容易出现耐药相关突变,尤其是ALK G1202R。37%患者存在TP53共突变。血浆中TP53突变可作为较差ORR及PFS的预后生物标记物。获得性耐药机制可分为ALK依赖性及ALK非依赖性,应用二代及以上TKI更易出现获得性耐药。本研究中仅2例患者出现耐药,未发现G1202R突变,应用布加替尼患者耐药后可出现非ALK突变。
摘要
本文报道ALTA-1L研究的最终结果。275例患者随机分入布加替尼组或克唑替尼组,3年PFS率分别为43%、19%。中位OS尚未达到。基线脑转移患者接受布加替尼治疗后OS获益更大(HR: 0.43; 95% CI: 0.21–0.89)。基线血浆出现EML4-ALK融合V3亚型及TP53共突变者PFS较差,无论ALK融合亚型和TP53突变状态如何,布加替尼疗效均优于克唑替尼。接受布加替尼治疗的患者很少出现ALK二次突变。针对于初治患者,布加替尼显示了持久的总体疗效和颅内疗效,且无论预后标志物如何,布加替尼的疗效、耐受性均优于克唑替尼,提示临床阶段在为ALK融合NSCLC制定一线治疗策略时应充分考虑患者ALK融合亚型以及伴随的共突变情况,精细化选择一线治疗药物或许能为患者带来更大的OS获益。
研究背景
晚期NSCLC中EML4-ALK基因融合发生率约为3%-5%,布加替尼为其口服TKI药物,在一线治疗ALK阳性NSCLC的III期ALTA-1L研究中,布加替尼疗效优于克唑替尼。布加替尼对大多数ALK继发性耐药突变也有疗效。
目前已发现15种EML4-ALK融合变体,常见的为V1、V2和V3,已有证据表明变体状态可能影响治疗效果和导致ALK抑制剂的获得性耐药。除此之外, TP53基因的共突变也会对治疗效果产生负面影响。但关于ALK抑制剂治疗EML4-ALK变体及TP53突变的数据非常有限,尤其是在一线治疗中。
本文报道了ALTA-1L研究的最终结果及安全性数据,随访时间长达40个月。阐述了布加替尼对EML4-ALK变体及其他共突变基因的疗效。
研究方法
研究设计及入组人群
ALTA-1L研究是一项随机、开放、多中心的III期研究。入组未经ALK靶向治疗的局部晚期或转移NSCLC患者,1:1随机入组布加替尼组(180mg,1/日)或克唑替尼组(250mg,2/日)。以基线是否存在脑转移、是否完成≥1个周期化疗为分层因素。克唑替尼组患者PD后可交叉入组至布加替尼组。在筛选期、C3D2、治疗结束时抽取血浆样本进行生物标记物的NGS检测。
研究终点
主要研究终点为PFS。次要研究终点包括ORR、颅内ORR及PFS、OS、DOR、安全性、QOL等。
研究结果
入组人群
研究共纳入275例患者,137名患者随机分配到布加替尼组,138名患者分配到克唑替尼组,两组中位随访时间分别为40.4个月、15.2个月。65例患者PD后交叉入组至布加替尼组,其中23例(35%)研究结束时仍在服用布加替尼。46%(19/41)基线脑转移患者出现交叉入组。
药物疗效
研究进一步证实布加替尼优于克唑替尼。BIRC评估3年PFS率分别为43%、19%,中位PFS分别为24.0个月和11.1个月(HR=0.48, p < 0.0001)(图1A);4年PFS率分别为36%、18%(图1A)。研究者评估3年PFS率分别为45%、18%,中位PFS分别为30.8个月和9.2个月(HR=0.43, p < 0.0001)(图1B)。两组中位DOR分别为33.2个月、13.8个月(图1D)。
基线脑转移患者中位颅内DOR分别为27.9个月、9.2个月。3年颅内PFS率分别为31%、9%;4年颅内PFS率分别为22%、NE(图1E)。65例交叉入组患者中,中位PFS为16.8个月,ORR为57%,中位DOR为19.1个月。停药接受后续抗肿瘤治疗的患者中,克唑替尼组后续接受ALK TKI的比例更高(85% VS 54%)。






图1. 布加替尼/克唑替尼一线治疗ALK+ NSCLC。A. BIRC评估PFS;B.研究者评估PFS;C.BIRC评估PFS的HR森林图;D. DOR;E. BIRC评估基线脑转移患者颅内PFS;F. BIRC评估所有患者颅内PFS。
布加替尼和克唑替尼组的3年OS率分别为71%、68%(图 2A)。4年OS率分别为66%、60%(图 2A)。克唑替尼组OS的HR为0.54(图2B)。基线脑转移患者死亡的HR为0.43(图2D),3年OS率分别为74%、55%;4年OS率分别为71%、44%。未经脑部放疗的患者接受布加替尼的生存获益更佳。无基线脑转移患者3年OS率分别为70%、73%;4年OS率分别为64%、67%。





图2. A. OS结果;B-C. 使用MSM及IPCW Cox模型进行交叉调整的OS敏感性分析;D. 基线脑转移患者的OS;E. 基线无脑转移患者的OS。
两组分别有46%、50%患者存在EML4-ALK融合,最常见的融合为V1和V3亚型(表1)。V3亚型患者的PFS及OS均劣于V1或V2亚型患者(表1,图 3A、3C)。对于所有变体亚组,布加替尼的ORR及PFS均优于克唑替尼(表1)。
布加替尼和克唑替尼组EML4-ALK融合患者中分别有39%和36%患者存在TP53基因的共突变(表1)。与TP53野生型患者相比,两组中突变患者的ORR及PFS均较差(PD的HR [95% CI]数值, TP53 突变 vs 野生型: 1.76 [0.81–3.83], 布加替尼; 1.77 [0.90–3.49],克唑替尼;表1、图3D),OS较短(死亡风险的HR [95% CI] 数值,TP53 突变 vs 野生型: 2.36 [1.00–5.58], 布加替尼; 1.98 [0.91–4.27], 克唑替尼;图3E)。无论TP53突变状态如何,布加替尼的ORR及PFS均优于克唑替尼(表1)。布加替尼治疗进展后尚无明确与耐药相关的基因突变模式。
表1. 基线ALK融合变体及TP53突变状态:发病率及疗效


表2. 安全性概览
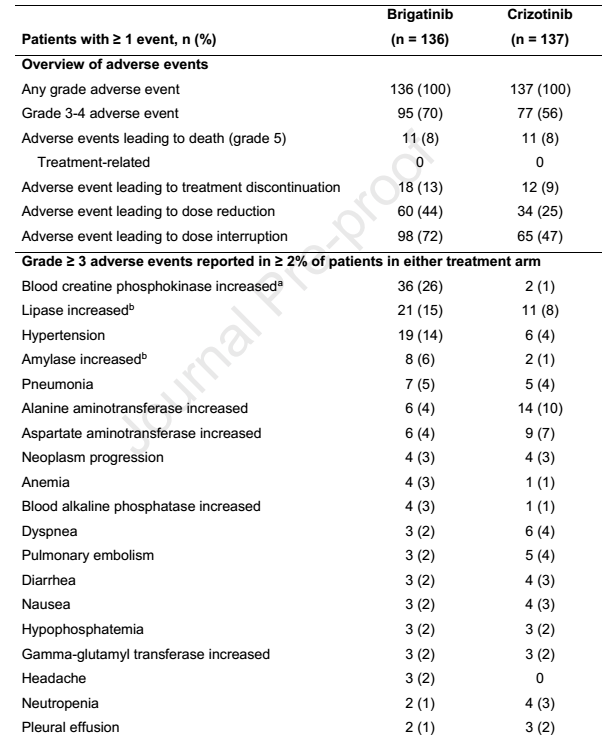






图3. A.不同EML4-ALK融合变体的的PFS;B. 按照基线分子临床协变量进行的PFS多变量分析;C. 不同EML4-ALK融合变体的的OS;D-E. 基线血浆TP53突变患者的PFS及OS。
讨论
ALTA-1L最终研究结果与既往中期分析保持一致。在PFS方面,布加替尼优于克唑替尼,降低52%疾病进展或死亡风险。布加替尼的DOR优于克唑替尼(33.2个月 vs 13.8个月)。OS数据尚未成熟。由于后续抗肿瘤治疗不均衡(包括交叉入组、克唑替尼组停药后接受后续治疗比例较高)等因素影响,两组OS结果相似。
布加替尼持续发挥强大的颅内抗肿瘤作用,降低所有患者56%的颅内进展风险,及71%脑转移患者颅内进展风险。颅内疗效可长期持续,布加替尼组中位颅内DOR达27.9个月,克唑替尼仅为9.2个月。尽管克唑替尼组患者交叉入组比例较高,基线脑转移患者应用布加替尼OS的HR 为0.43,表明脑转移患者一线ALK-TKI应用布加替尼可提高生存获益。布加替尼在颅内的高应答率及DOR时间为后续研究中的最佳药物顺序提供了理论依据。
与既往研究结果相一致,血浆中EML4-ALK融合变体以V1及V3为主导。布加替尼在V1、V2、V3变体中的疗效均优于克唑替尼。与V1变体相比,V3患者无论布加替尼或克唑替尼治疗,PFS均呈明显缩短(P=0.002)。且V3亚型后续更容易出现耐药相关突变,尤其是ALK G1202R。37%患者存在TP53共突变。血浆中TP53突变可作为较差ORR及PFS的预后生物标记物。
获得性耐药机制可分为ALK依赖性及ALK非依赖性。应用二代及以上TKI更易出现获得性耐药。本研究中仅2例患者出现耐药,未发现G1202R突变。布加替尼治疗患者耐药后可出现非ALK突变。
参考文献:
Brigatinib versus Crizotinib in Anaplastic Lymphoma Kinase(ALK) Inhibitor-Naïve Advanced ALK-Positive Non-Small Cell Lung Cancer: Final Results of the Phase 3 ALTA-1L Trial. JTO. 2021 July 30.






