臻知识·专家访谈 | 第18期

目前,对于免疫治疗巩固治疗的疗效预测生物标记物仍然受到重视,III期不可切除NSCLC的部分患者仍能从免疫治疗中得到明显获益。求臻医学特邀湖北省肿瘤医院放疗中心韩光教授,结合近期发表在European Journal of Cancer杂志上的文章进行解读。
韩光教授:PACIFIC研究奠定了度伐利尤单抗在III期不可切除NSCLC患者放化疗后的巩固治疗地位,Ⅲ期临床数据显示度伐利尤单抗显著改善患者预后。值得注意的是该研究还纳入了驱动基因突变阳性的患者,然而此类患者是否能从免疫治疗中获益仍备受争议。最近有项研究评价了EGFR突变阳性患者接受度伐利尤单抗巩固治疗的疗效,其有效率低,免疫相关的不良反应发生率高。然而针对Ⅲ期不可切除NSCLC,不同的驱动基因突变状态是否会影响度伐利尤单抗巩固治疗疗效仍未知。
本研究通过多中心回顾性分析III期不可切除且驱动基因变异的NSCLC患者数据发现,入组患者中位随访时间为18.5个月,ORR为45%,DCR为86%,中位PFS为17.5个月,中位OS为47.0个月。携带驱动基因变异与未携带驱动基因变异患者的中位PFS无明显差异:分别为14.9个月vs 18个月。然而当针对驱动基因变异组中的特定基因去进行分析时发现KRAS 突变患者获益最佳(中位PFS未达到),而ALK重排及EGFR突变患者的中位PFS最差(分别为7.8个月、8.1个月)。放化疗后行度伐利尤单抗巩固治疗,携带EGFR/BRAF突变及ALK重排患者的疗效有限,但在KRAS突变患者中疗效相对较好。提示针对于这部分患者,仍需要借助基因检测进行人群筛分,进而作出对患者获益最大的临床决策。
IMMUNOTARGET研究和Foudation Medicine针对于4000多例样本的回顾性分析都已证实EGFR和ALK变异阳性的晚期NSCLC患者接受免疫治疗疗效不佳,KRAS突变患者接受免疫治疗疗效较好,该研究亦证实针对于局晚期患者的巩固免疫治疗结论成立。然而针对于BRAF突变,该研究没进行细分,但之前有相关报道称BRAF V600E突变的患者也可从免疫治疗中获益。另外,针对可手术的Ⅲ期NSCLC患者,携带EGFR敏感突变的患者可接受EGFR-TKI的术后辅助治疗已被写进指南,但是针对不可手术的Ⅲ期驱动基因阳性NSCLC患者的最佳治疗策略仍值得进一步探索,有研究提示这部分患者可从根治性放化疗后的EGFR-TKI的维持治疗中获益,疗效优于度伐利尤单抗巩固治疗,但样本量较小,期待未来有相关的大样本临床研究结果公布能给我们明确答案。总之,在精准治疗时代,我们需要依靠分子标志物对患者进行精细化分层和优化管理,使患者获得最大的生存获益。
摘要
针对于III期NSCLC患者,放化疗后接受度伐利尤单抗的巩固治疗是标准治疗方法,但在驱动基因变异(dGA)患者中的疗效尚缺乏研究。本研究通过多中心回顾性分析III期不可切除且驱动基因变异的NSCLC患者数据发现,入组患者中位随访时间为18.5个月,ORR为45%,DCR为86%,中位PFS为17.5个月,中位OS为47.0个月。携带驱动基因变异与未携带驱动基因变异患者的中位PFS无明显差异:14.9个月vs 18个月。然而当针对驱动基因变异组中的特定基因去进行分析时发现KRAS 突变患者获益最佳(中位PFS未达到),而ALK重排及EGFR突变患者的中位PFS最差(分别为7.8个月、8.1个月)。放化疗后行度伐利尤单抗巩固治疗,携带EGFR/BRAF突变及ALK重排患者的疗效有限,但在KRAS突变患者中疗效相对较好。提示针对于这部分患者,仍需要借助基因检测进行人群筛分,进而做出对患者获益最大的临床决策。
研究背景
PACIFIC研究奠定了度伐利尤单抗在III期不可切除NSCLC患者放化疗后的巩固治疗地位,Ⅲ期临床数据显示度伐利尤单抗显著改善患者预后,中位PFS为17.2个月,中位OS达47.5个月。该研究还纳入了携带驱动基因变异的患者,然而此类患者是否能从免疫治疗中获益仍备受争议。最近有项研究评价了EGFR突变阳性患者接受度伐利尤单抗巩固治疗的疗效,其有效率低,免疫相关的不良反应发生率高。然而针对于Ⅲ期不可切除NSCLC,不同的驱动基因突变状态是否会影响度伐利尤单抗巩固治疗疗效未知。
研究方法
纳入来自欧洲及美国的26家治疗中心,2015年4月至2020年10月经放化疗后未进展、且接受度伐利尤单抗巩固治疗的的III期不可切除的NSCLC患者的临床及分子学资料并进行回顾性分析。驱动基因变异包括EGFR/BRAF/KRAS突变、ALK/ROS1重排。PD-L1表达状态通过免疫组化评估(≥1%定义为阳性)。
研究结果
基线特征
研究共纳入323例患者,基线特征见表1。43例(23%)携带驱动基因变异:8例携带EGFR突变(2例19del、4例21mut);4例ALK重排;5例BRAF突变(4例V600E);26例KRAS突变(8例G12C)。

表1. 患者基线特征
疗效数据
入组患者中位随访时间为18.5个月,ORR为45%,DCR为86%,中位OS为47.0个月,中位PFS为17.5个月。最终有145例患者在度伐利尤单抗治疗期间或治疗后出现疾病进展,最常见进展部位为胸部局部。
携带驱动基因变异的患者(dGA)中,度伐利尤单抗治疗的中位持续时间为8.8个月。14例(33%)患者完成12个月的巩固治疗,4例患者在数据分析时仍在接受治疗。23例(53%)患者终身停用度伐利尤单抗:14例由于毒副作用、8例由于疾病进展、1例由于患者自身决定。2例患者在出现疾病寡转移(脑部、胸部)后继续应用度伐利尤单抗。
携带驱动基因变异与未携带驱动基因变异患者的中位PFS无明显差异:14.9个月vs 18个月(图1A)。然而当针对驱动基因变异组中的特定基因去进行分析时发现KRAS突变患者获益最佳(中位PFS未达到),而ALK重排及EGFR突变患者的中位PFS最差(分别为7.8个月、8.1个月)(表2、图1B)。
在dGA患者中,中位PFS与PD-L1表达并无关联,但与吸烟状态相关(吸烟者19.2个月vs 不吸烟者5.8个月)。
dGA患者18个月的总生存率为93.4%,但OS数据尚未成熟。
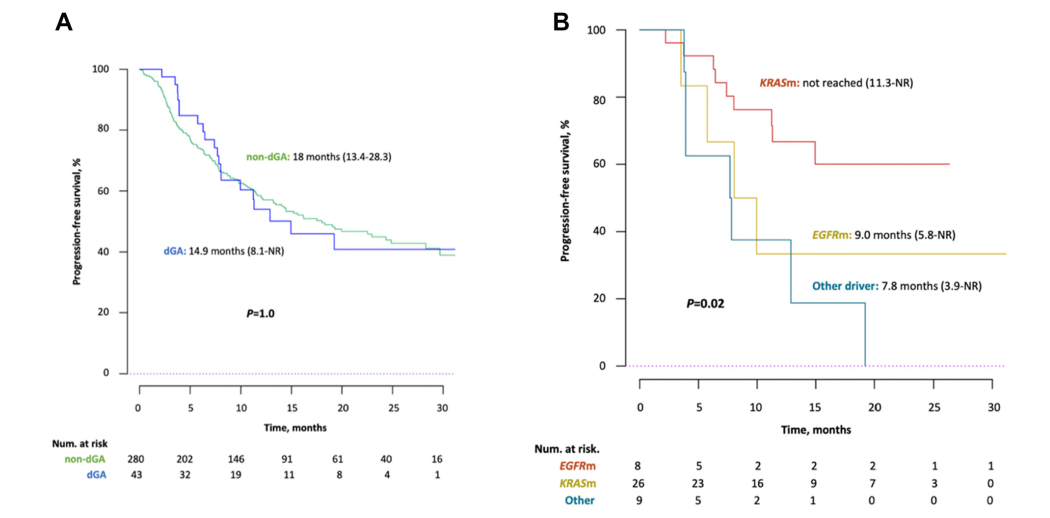
图1. 不同驱动基因改变状态患者的PFS
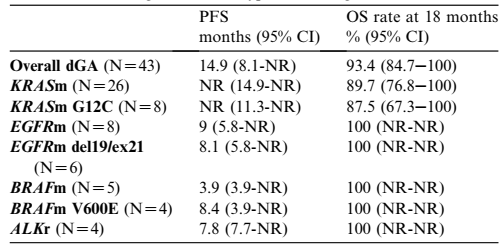
表2.不同类型驱动基因改变患者的临床结局
安全性
共157例患者出现irAEs,平均分级为1级。肺炎是最常见免疫治疗相关副反应,发生率为21%,11名(6%)患者发生3-4级不良反应,仅有1例(0.5%)患者发生5级不良反应。dGA患者及非dGA患者在irAEs方面并无差异(63% VS 52%,P=0.11)。
讨论
本研究对43例携带驱动基因变异的III期不可切除NSCLC患者接受度伐利尤单抗巩固治疗疗效的结果进行综合分析。结果发现中位PFS在不同分子亚组之间存在显著差异,KRAS突变患者获益最佳(中位PFS尚未达到),ALK重排患者中位PFS最短(仅为7.8个月)。
与PACIFIC研究不同,本研究中脑转移率约为14%,而PACIFIC研究中仅为6.3%。这可能是由于本研究纳入真实世界患者队列有其内在较差的临床特征,例如年龄较大,平均66岁;2%患者ECOG PS评分为2分;19%接受序贯治疗,放疗结束后开始度伐利尤单抗的时间晚于dGA患者等等。
而在PACIFIC研究最终分析中,约半数试验组患者在4年时仍存活。但患者并未进行基因状态的筛选,所以仅43例(6%)EGFR突变患者被纳入研究,其中29例在度伐利尤单抗组。因此遗憾的是,基于EGFR突变状态的亚组探索性分析由于样本量较小,并未呈现显著差异。
多项研究均已证实KRAS突变患者接受免疫治疗具有优势,以及ALK重排患者并不能明显获益于免疫治疗。本研究则为某些驱动基因变异(如ALK重排)接受免疫治疗的有限疗效提供进一步支持证据。但仍不能推及所有基因变异亚组,例如KRAS亚组患者的PFS可得到显著延长。
另外,局部进展期的吸烟NSCLC患者中可观察到免疫治疗较好的疗效,如本文所示。而KRAS突变的NSCLC患者通常为重度吸烟患者。
目前,对于免疫治疗巩固治疗的疗效预测生物标记物仍然受到重视,III期不可切除NSCLC的部分患者仍能从免疫治疗中得到明显获益。多项研究表明,EGFR突变患者(包括一些EGFR 20外显子突变,其中只有2例20外显子插入突变患者)从免疫治疗中获益有限。在本研究中,对2例EGFR 20外显子罕见突变单独分析,发现其从度伐利尤单抗治疗中的获益极为有限,等同于常见EGFR突变亚组患者。