臻话RNA | 第四期

近年来,肿瘤精准医疗飞速发展,尤其是ALK、ROS1、RET、NTRK、FGFR等以结构变异为主的靶向药物陆续上市,越来越多患者从中获益。目前,基于DNA变化分析为主的精准医疗正在被临床广泛应用,实际上,基于RNA的NGS检测(RNA-NGS)在结构变异检测上展现出更加优越的性能,已被《NCCN 非小细胞肺癌临床实践指南》、《NCCN 结肠癌临床实践指南》、《骨与软组织肿瘤二代测序中国专家共识》等指南及专家共识收录。同时,RNA种类繁多、功能复杂,RNA-NGS应用也更为广泛……RNA在膀胱癌分子分型中的应用如何?接下来,让我们跟随求小臻的步伐进入今天的分享主题吧。
膀胱癌是泌尿系统常见的肿瘤之一,我国每年有8.5万人罹患膀胱肿瘤,因病死亡人数达到4万人。根据肿瘤的浸润深度和是否转移,膀胱癌分为非肌层浸润性膀胱癌(non-muscle invasive bladder cancer, NMIBC)、 肌层浸润性膀胱癌(muscle-invasive bladder cancer, MIBC)以及晚期转移性膀胱癌。MIBC约占总膀胱癌的20%,另有将近一半的NMIBC患者会复发为MIBC。目前MIBC的治疗方式主要包括:新辅助化疗、根治性膀胱切除术、膀胱部分切除术、术后辅助化疗、辅助免疫、保留膀胱综合治疗等等。随着精准医学的发展,基于转录组(RNA)的分子分型,为MIBC的精准诊疗提供了参考。
MIBC分子分型
膀胱癌分子分型最早由隆德大学(Lund University)的研究者发起的,研究纳入了308例不同分期的膀胱癌患者,取肿瘤组织进行基于RNA转录组的基因表达富集分析,根据其表达富集情况将膀胱癌聚类为5个亚型,分别为Urobasal A型、Urobasal B型、基因组不稳定型 (Genomically unstable)、鳞状细胞样型(SCC-like)和浸润型(Infiltrated)。五种亚型预后差异较大,Urobasal A型预后最好,而Urobasal B型和SCC-like型预后较差。
紧随其后,2014年北卡罗来纳大学(University of North Carolina,UNC)的研究者和美国德州大学MD安德森癌症中心(University of Texas M.D. Anderson Cancer Center,MDA)的研究者也对MIBC患者进行基于RNA转录组的基因富集分析,分别形成了UNC分型(管腔样细胞型,luminal;基底样细胞型,basal)和MDA分型(基底样型,basal;管腔样型,luminal;p53样型,p53-like),使得MIBC分子分型进入了一个新时代。
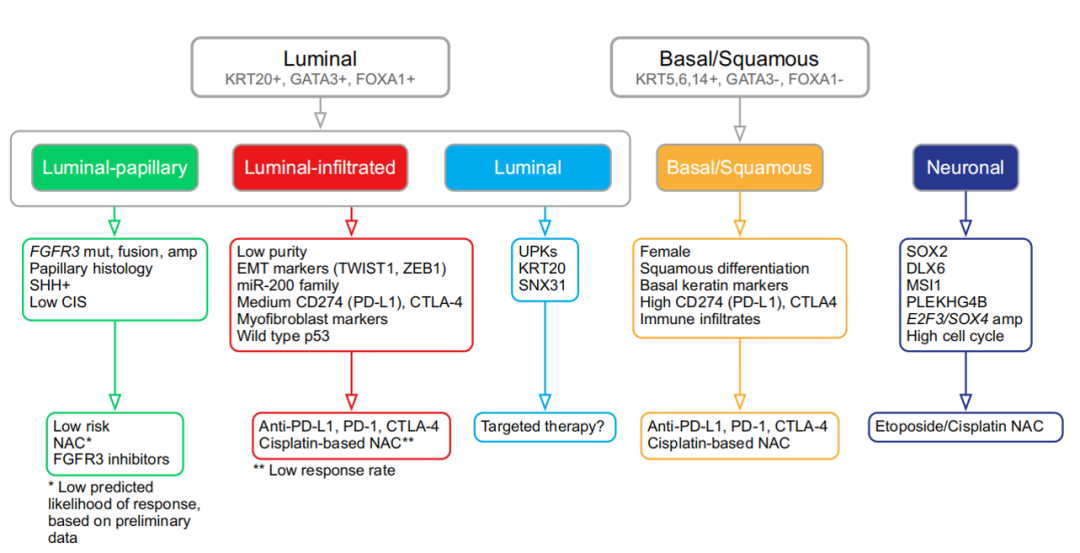
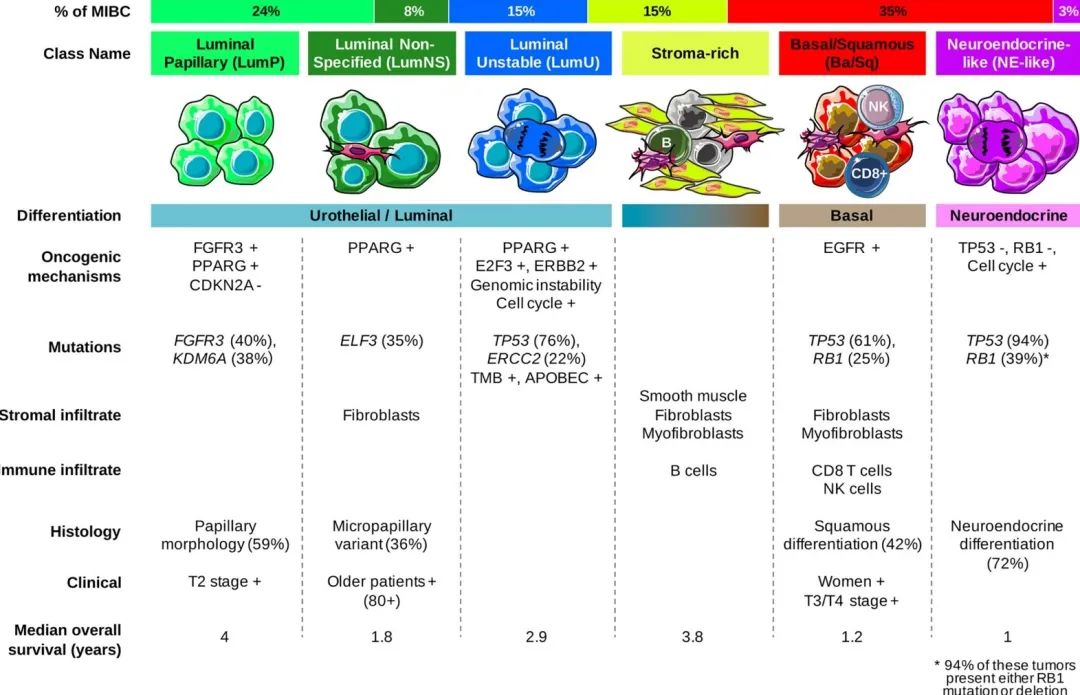
目前最为临床接受的MIBC分子分型是基于TCGA数据库的TCGA分型和基于膀胱癌分子分型协作组共识的EU分型。TCGA分型将MIBC分为管腔-乳头状型(luminal-papillary)、管腔-浸润型(luminal-infiltrated)、管腔型(luminal)、基底/鳞状细胞型(basal-squamous)、神经内分泌型(neuronal)。而EU分型将MIBC分为六种亚型:管腔乳头型(LumP)、管腔非特异型(LumNS)、管腔不稳定型(LumU)、基质富集型(stroma-rich)、 基底/鳞状细胞癌型(Ba/Sq)及神经内分泌型(NE-like)。基于基因组学和转录组学的研究发现,各亚型表现出不同的分子特征,如图一所示。
图1A TCGA分型中不同亚型特征,B EU分型中不同亚型特征
(左右滑动查看更多)
EAU指南推荐对于肌层浸润性膀胱癌,TCGA分型和EU分型检测应用于临床,而最新的中国《膀胱癌诊疗指南(2022版)》推荐EU分型检测应用于临床。基于此,膀胱癌分子分型成为了MIBC诊疗中的一环,为MIBC的判断预后、预测药物反应提供参考。

图2. EAU指南(左)和中国膀胱癌诊疗指南(右)
膀胱癌分子分型的临床应用
2.1 新辅助化疗
新辅助化疗是MIBC治疗的重要手段之一,通过手术前系统的含铂化疗,将肿瘤缩瘤降期,达到有利于手术,延长患者生存时间的目的。尽管EAU/NCCN/AUA 三大指南均已将新辅助化疗纳入临床治疗中,但是5年OS率仅仅从45%提升到50%,因此,新辅助化疗获益相对不高限制了其临床应用。据报道,MIBC新辅助化疗的应用比例仅在10%~20%之间,而中国的临床应用比例更低,并且回顾性分析显示,对于新辅助化疗疗效不佳的患者,往往进展更快,总生存更差,这也限制了新辅助化疗的临床应用。
随着分子分型的发展与应用,分子分型可以指导新辅助化疗的治疗。2022年的一项回顾性研究,回顾了828例接受过根治术(RC)的膀胱癌患者,筛选后总计601例符合标准的患者。新辅助化疗(NAC)组247例患者,非新辅助化疗(non-NAC)组354例患者,根据分子分型患者分为luminal亚型和非luminal亚型,以评估分子亚型是否会影响患者对NAC的应答。
结果发现,对于luminal亚型的患者,无论是否接受新辅助化疗,其治疗结果相似。接受新辅助化疗的luminal亚型患者2年OS率为82%,3年OS率为63%。未接受新辅助化疗的luminal亚型患者2年OS率为78%,3年OS率为65%。相反,接受新辅助化疗的非luminal亚型患者疗效优于不接受新辅助化疗的非luminal亚型患者,接受组2年OS率为78%,3年OS率为71%,而未接受组为69%和61%(p=0.01)。提示对于非Luminal亚型的患者,进行新辅助化疗获益更大。
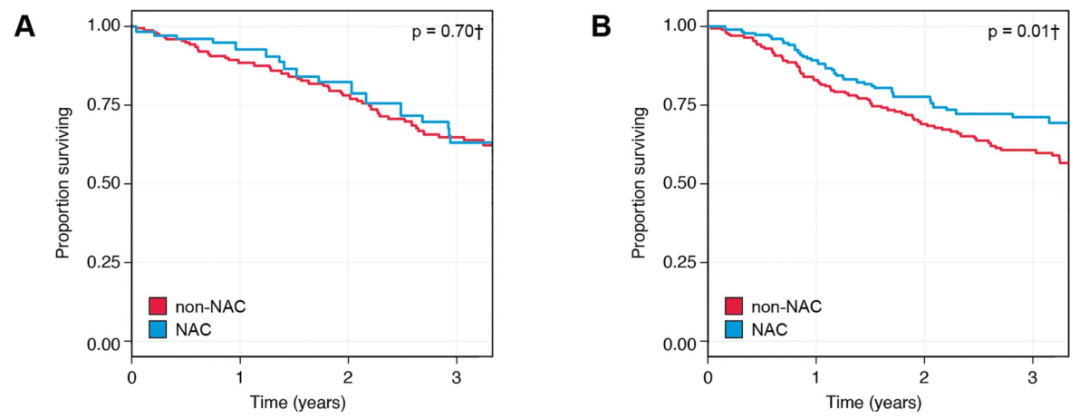
图3. Luminal亚型(图A)和non-Luminal亚型(图B)是否接受新辅助化疗疗效对比
同样来自EU的报道,根据TCGA分型和EU分型,同样可以预测新辅助化疗的预后,研究显示,无论TCGA分型还是EU分型,神经内分泌型患者,预后最差。

图4. 新辅助化疗疗效与EU分型(左)和TCGA分型(右)的关系
2.2新辅助免疫
随着以PD-1/L1为代表的免疫检查点抑制剂为代表的免疫治疗在膀胱癌治疗中的获批,膀胱癌治疗进入了免疫治疗时代,同时新辅助免疫治疗也成为了临床治疗中的重要选择。
研究报道,帕博利珠单抗(PURE-01研究)新辅助治疗pCR率达到36%,ORR达到56%。阿替利珠单抗(ABACUS研究)新辅助治疗pCR率达到31%,ORR达到39%,均取得了显著疗效。同时,通过回顾性分析新辅助免疫治疗疗效与不同分子亚型之间的关系,PURE-01研究显示,通过EU分型显示,LumU和Ba/Sq型新辅助免疫pCR和ORR较高(LumU:pCR=42%,ORR=68%;Ba/Sq:pCR=46%,ORR=65%),而Stroma-rich型新辅助免疫响应最差(pCR=17%,ORR=33%)。在TCGA分型系统下,Ba/Sq新辅助免疫响应好,pCR和ORR均较高(Ba/Sq:pCR=50%,ORR=65%),Luminal型则新辅助免疫响应较差(pCR=18%,ORR=47%)。同样ABACUS研究也发现,分子分型与新辅助免疫治疗疗效相关。
2022年ASCO年会最新报道了中国人群MIBC不同分子亚型的患者,接受替雷利珠单抗联合白蛋白紫杉醇新辅助治疗的情况。研究共纳入16例MIBC患者,Ba/Sq型和LumU型新辅助治疗疗效最佳,ORR分别达到85.7%(6/7)和75%(3/4),与既往研究结果相似,为中国人群分子分型指导MIBC新辅助免疫治疗提供参考。因此,对于新辅助免疫治疗而言,膀胱癌分子分型,可以更好的预测治疗应答情况。
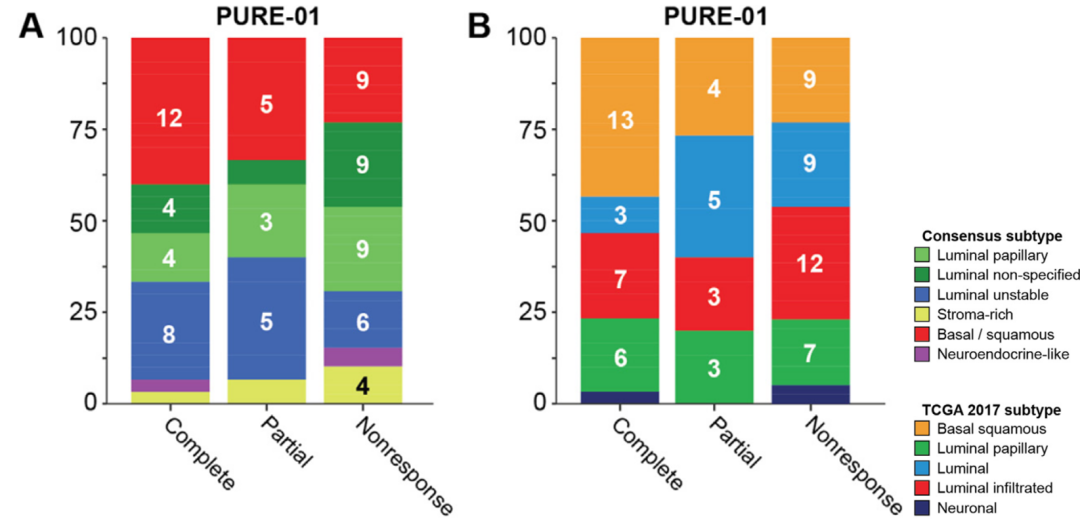
图5. 新辅助帕博利珠单抗临床疗效与分子分型的关系。A. EU分型。B. TCGA分型
总结
膀胱癌分子分型已经成为EAU指南和中国膀胱癌诊疗指南推荐的重要分子检测内容,指导膀胱癌的预后分层和精准治疗,尤其在新辅助化疗和新辅助免疫疗效预测方面,具有重大的临床应用价值,期望为更广大的膀胱癌患者临床治疗,带来更大的获益。

求臻医学ChosenMaster
打开膀胱癌诊疗新格局
求臻医学自主研发的ChosenMaster膀胱癌分子分型检测方案,基于RNA测序(RNA-seq)技术,根据基因表达,对膀胱癌进行多种国际权威分子分型,包括TCGA分型(4000+基因)、EU分型(850+基因)等分子分型以及免疫分型(PD-L1、CD8A/CYT)。该检测方案采用去核糖体链特异性建库方式,可有效弥补FFPE等降解程度较高的样本5’端RNA信息丢失的问题,极大地提升了检测准确性。
该检测方案可提示肌层浸润性膀胱癌和BCG灌注失败的高危非肌层浸润膀胱癌等疾病相关的化疗、免疫治疗及预后情况,尤其是需制定新辅助治疗方案的肌层浸润性膀胱癌(MIBC)患者以及有较高保膀胱意愿的患者。基于此,求臻医学将搭建中国人群膀胱癌数据库,构建国人适用的分子分型模型,为国人膀胱癌诊疗再添助力。