臻知识·专家访谈 | 第30期

近年来免疫检查点抑制剂在各种恶性肿瘤的治疗中都取得了不错的临床疗效,但在晚期前列腺中的研究结果却不尽人意。前列腺癌被认为是“冷肿瘤”,联合其他药物提高疗效或是寻找分子标志物筛选优势人群是近年来的研究热点。求臻医学特邀四川省人民医院泌尿外科李俊教授,结合近期发表在Journal for ImmunoTherapy of Cancer杂志上的文章进行解读。
李俊教授:随着PARP抑制剂和免疫治疗药物在前列腺癌中获批,转移性去势抵抗性前列腺癌(mCRPC)患者的预后得到了改善。指南推荐所有mCRPC患者进行至少包含HRR基因胚系及体系变异的检测,指导PARP抑制剂治疗,而免疫治疗更适合检测出错配修复缺陷或微卫星高度不稳定性的患者。有学者假设在免疫治疗基础上,联合其他抗肿瘤治疗或许可改善前列腺癌的肿瘤微环境,增强其对免疫治疗的应答。PARP抑制剂可降低DNA错配修复功能,诱导细胞死亡,进而释放出更多的肿瘤新生抗原,提升肿瘤免疫原性,从作用机制看,联合免疫检查点抑制剂具有协同作用,但借助分子标志物的优势人群筛选尚缺乏研究。
近期在Journal for ImmunoTherapy of Cancer杂志上发表了一篇相关文章,基于CheckMate 9KD研究,对接受纳武利尤单抗和卢卡帕利联合治疗的A1和A2队列进行疗效和分子标志物探索性分析。A1队列纳入了既往 1-2 线紫杉类方案失败、≤ 2 线新型内分泌治疗(NHT )失败的 88例mCRPC 患者,HRD阳性患者占比51.1%;A2队列纳入既往接受过 NHT 治疗失败但未经过化疗的 71例mCRPC 患者,HRD阳性患者占比47.9%。同源重组缺陷(HRD)状态通过NGS Panel检测,并同时进行了HRR基因和TMB等标志物的分析。
研究发现A1队列(化疗经治)中所有患者、HRD阳性和BRCA1/2突变阳性患者的ORR 分别为 10.3%、17.2%和33.3%;PSA 应答率分别为 11.9%、18.2%和41.7%,中位 rPFS分别为4.9、5.8和5.6个月,中位 OS 分别为13.9、15.4和15.2个月。A2队列(未接受过化疗)中所有患者、HRD阳性和BRCA1/2突变阳性患者的ORR 分别为 15.4%、25.0%和33.3%;PSA 应答率分别为 27.3%、41.9%和84.6%,中位 rPFS分别为8.1、10.9和10.9个月,中位 OS 分别为20.2、22.7和20.2个月。根据中位TMB去进行亚组分析,并未观察到疗效差异。
值得注意的是BRCA1/2突变患者的ORR及PSA应答率较HRD阳性患者有一定优势,但并未转化为最终的rPFS和mOS获益,两组的生存获益相当,尽管样本量较小,本研究中观察到非BRCA突变的 HRD阳性患者亦可从联合治疗中获益。
综上,本研究提示对于mCRPC患者,无论既往是否接受过化疗,均应进行基因检测明确HRD和BRCA1/2突变状态,该类患者有望从IO联合PARP抑制剂治疗中获益,尤其是针对于HRD的检测,可将获益人群提高到近50%。
摘要
CheckMate 9KD研究是转移性去势抵抗性前列腺癌(mCRPC)患者接受纳武利尤单抗联合其他治疗的非随机、多中心II期研究。本文报告纳武利尤单抗联合卢卡帕利队列的相关数据,发现A1队列(化疗经治)中所有患者、HRD阳性和BRCA1/2突变阳性患者的ORR 分别为 10.3%、17.2%和33.3%;PSA 应答率分别为 11.9%、18.2%和41.7%,中位 rPFS分别为4.9、5.8和5.6个月,中位 OS 分别为13.9、15.4和15.2个月。A2队列(未接受过化疗)中所有患者、HRD阳性和BRCA1/2突变阳性患者的ORR 分别为 15.4%、25.0%和33.3%;PSA 应答率分别为 27.3%、41.9%和84.6%,中位 rPFS分别为8.1、10.9和10.9个月,中位 OS 分别为20.2、22.7和20.2个月。且两药联合安全性较好。本研究提示无论既往是否接受过化疗,HRD状态和BRCA1/2突变状态可用于mCRPC患者接受纳武利尤单抗联合卢卡帕利治疗的优势人群筛选。
研究背景
近年来,随着化疗、PARP抑制剂和免疫治疗等药物的相继获批,mCRPC预后得到改善,但mCRPC仍然是一类不可治愈的致命恶性肿瘤,还需探索新的治疗策略。有学者提出在免疫治疗基础上,联合其他抗肿瘤治疗能改善前列腺癌肿瘤微环境,增强其对免疫治疗的应答,目前已开展多项相关临床试验。
欧洲及美国已批准PARP抑制剂用于携带DNA缺陷修复基因突变的mCRPC患者,其中有些基因与同源重组修复缺陷(HRD)相关。TRITON2研究中,卢卡帕利单药治疗携带BRCA1/2突变的经治mCRPC患者,ORR达43.5%,PSA应答率达54.8%。PARP抑制剂可降低DNA错配修复功能,诱导细胞死亡,进而释放出更多的肿瘤新生抗原,增加肿瘤免疫原性,联合PD-1/PD-L1免疫检查点抑制剂具有协同作用。因此,可在mCRPC患者中尝试二者的联合治疗。
CheckMate 9KD研究意在于评价纳武利尤单抗联合卢卡帕利用于mCRPC患者的治疗疗效,本文针对队列A1及队列A2的研究结果进行最终分析。
研究方法
·研究设计及入组人群
CheckMate 9KD研究是一项针对 mCRPC患者的非随机、开放、多队列的II期研究,包括纳武利尤单抗联合卢卡帕利(队列A1及A2)、多西他赛(队列B)、恩杂鲁胺(队列C)3个治疗组。在出现去势抵抗后,队列A1患者纳入既往 1-2 线紫杉类方案化疗失败、≤ 2 线新型内分泌治疗(NHT )失败的 mCRPC 患者。队列A2纳入既往接受过 NHT 治疗失败但未经过化疗的 mCRPC 患者。
·治疗方案
队列A1和A2患者接受纳武利尤单抗(480 mg,静注,4周一次) 联合卢卡帕利(600mg,2/日)治疗。若疾病无进展,纳武利尤单抗最多使用2 年。卢卡帕利可持续应用至疾病进展。
·研究终点及评估
主要研究终点为ORR及PSA应答率(PSA50-RR:与基线相比,PSA下降超过50%)。HRD状态通过NGS Panel进行检测,样本包括组织及血浆,两者判读规则稍有差异,但其中任一样本阳性即判定此患者HRD状态为阳性。
研究结果
入组患者
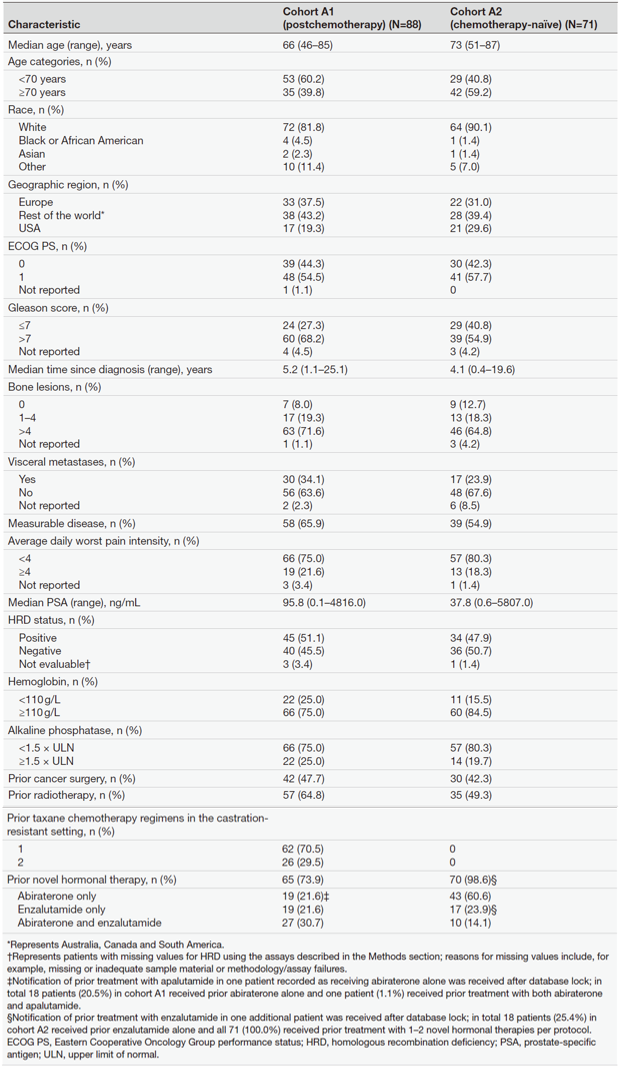
分别有88及71例患者进入队列A1及A2,基线特征见表1。两个队列患者中位年龄分别为66岁和73岁,各有34.1%、23.9%的患者存在内脏转移,HRD阳性比例为51.1%及47.9%。
表1. 队列A1及队列A2的基线人口及临床特征
药物暴露时间
纳武利尤单抗联合卢卡帕利的治疗中位时间分别为4.4个月、5.8个月。纳武利尤单抗治疗中位时间分别为3.7个月、4.6个月;卢卡帕利治疗中位时间分别为4.0个月、5.5个月。
队列A1(化疗后)疗效
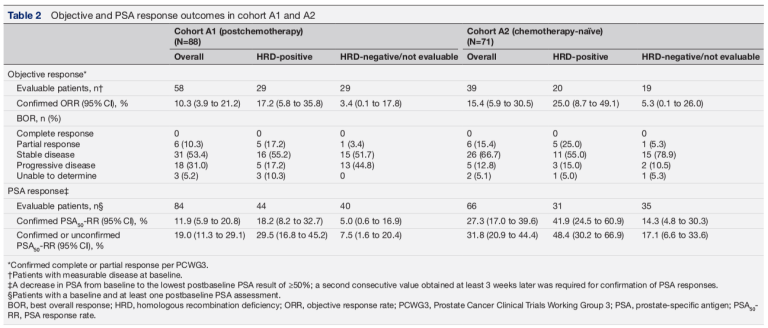
整体ORR为10.3%,6名患者达到PR(表2)。中位应答时间为1.9个月,中位应答持续时间为6.5个月,PSA应答率为11.9%(表2)。中位PSA进展时间为3.8个月。中位rPFS时间为4.9个月(图1A),中位OS为13.9个月(图1B)。
基线HRD阳性和HRD阴性/未知患者的ORR为17.2%、3.4%(表2)。PSA应答率分别为18.2%、5.0%。rPFS分别为5.8个月及3.7个月,中位OS分别为15.4个月及9.4个月(图1A、B)。
表2. 队列A1及队列A2的客观缓解及PSA应答率
队列A2(未化疗)疗效
整体ORR为15.4%,6名患者达到PR(表2)。中位应答时间为2个月,中位应答持续时间为7.1个月,PSA应答率为27.3%(表2)。中位PSA进展时间为3.5个月。中位rPFS时间为8.1个月(图1C),中位OS为20.2个月(图1D)。
基线HRD阳性和阴性/未知患者的ORR为25.0%、5.3%(表2)。PSA应答率为41.9%、14.3%。rPFS分别为10.9个月及5.6个月,中位OS分别为22.7个月及19.0个月(图1 C、D)。
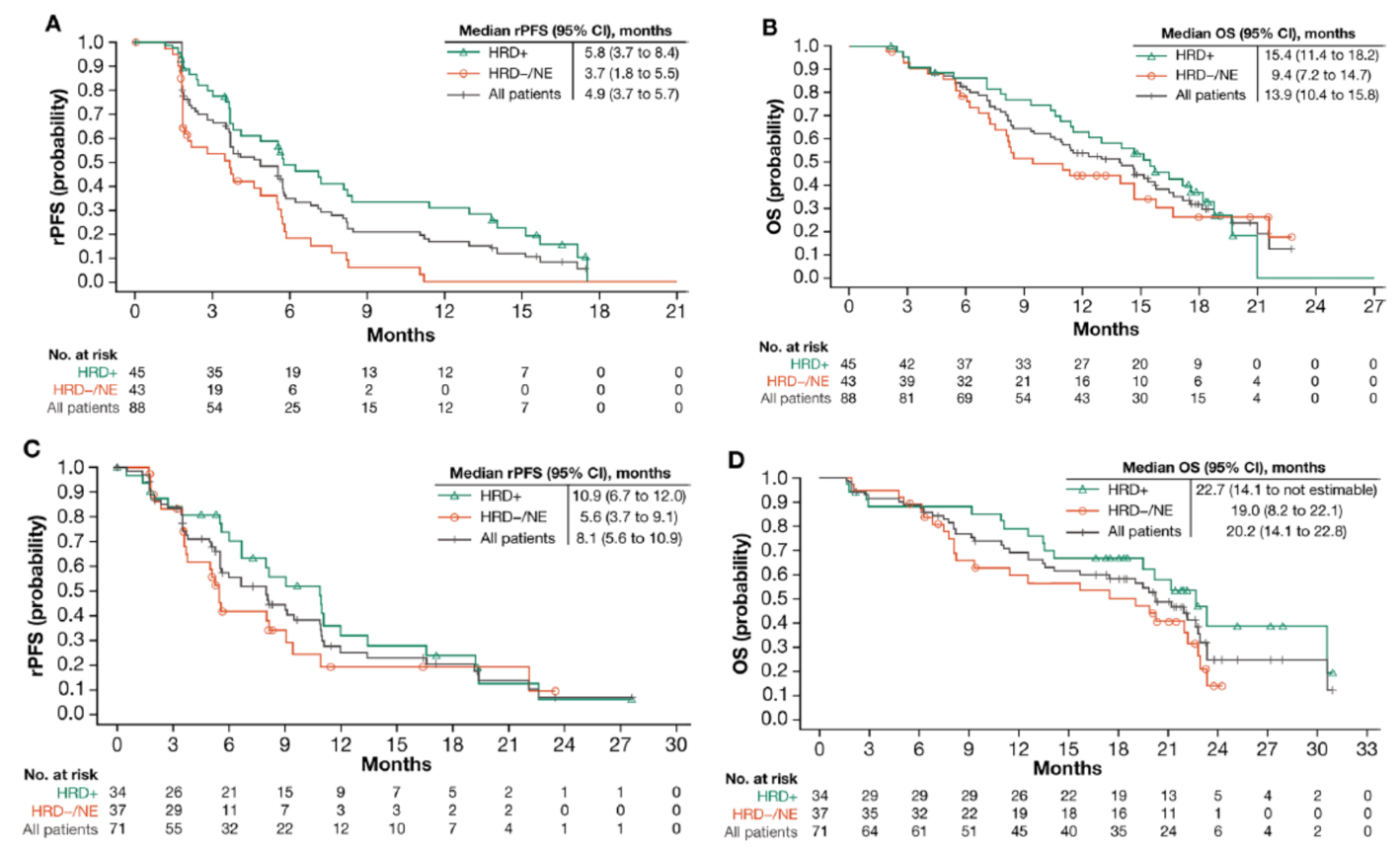
图1. 队列A1(A、B)及队列A2(C、D)中所有患者及不同HRD状态患者的rPFS及OS
A1和A2组的生物标志物分析
两个队列中最常见突变基因为BRCA1/2和ATM,大部分是移码突变或截短突变。图2及图3分别显示不同HRD基因突变患者的肿瘤大小及PSA水平变化。
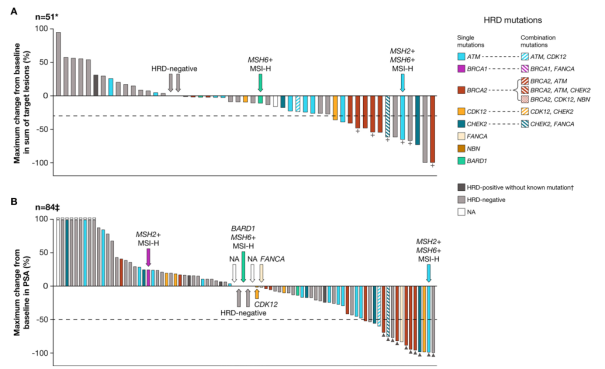
图2. 队列A1中不同HRD相关基因突变患者基线肿瘤大小(A)及PSA水平(B)变化的瀑布图
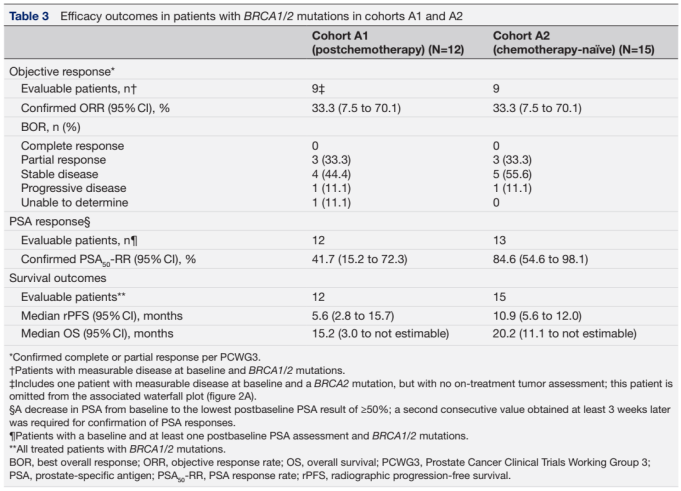
在队列A1的BRCA1/2突变患者中,6/9可测量的靶病灶缩小≥30%(图2A,表3)。12例可评估PSA的BRCA1/2突变患者中,6/12 PSA下降≥50%(图2B,表3)。在队列A2的BRCA1/2突变患者中,3/9可测量的靶病灶缩小≥30%(图3A,表3)。13例可评估PSA的BRCA1/2突变患者中,所有患者PSA下降≥50%(图3B,表3)。BRCA1/2突变患者的rPFS和OS见表3。
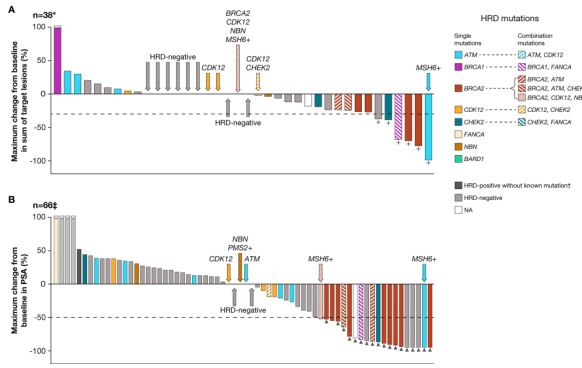
图3. 队列A2中不同HRD相关基因突变患者基线肿瘤大小(A)及PSA水平(B)变化的瀑布图
A1和A2队列中分别有82名和60名患者的TMB已知,但是根据中位TMB(6.7 mut/Mb)去划分不同亚组,未观察到疗效差异。
表3. 队列A1及队列A2中BRCA1/2突变患者的疗效
安全性
安全性数据见表4。两队列中最常见不良事件为恶心、乏力及贫血。3-4级不良事件发生率分别为27.3%及18.3%。两队列中最常见3-4级不良事件分别为贫血(6.8%)、转氨酶升高(5.6%)。
表4. 队列A1和队列A2中所有患者的治疗相关AEs
讨论
本研究表明纳武利尤单抗联合卢卡帕利在未经选择的mCRPC患者中的疗效有限,无新的不良事件发生。不同HRD突变状态分层分析显示无论既往是否接受过化疗,HRD阳性患者疗效及生存均获益显著。而且,尽管样本量较小,仍观察到BRCA1/2突变患者的ORR及PSA应答率较HRD阳性患者进一步提高,生存获益与HRD阳性组相当。
值得注意的是,在既往德瓦鲁单抗联合奥拉帕利治疗mCRPC患者的研究中,多数应答者携带BRCA突变,近期帕博利珠单抗联合奥拉帕利的研究中也观察到类似结果,进而支持本项研究结果。本文结果亦在意料之中,既往研究显示PARP抑制剂治疗BRCA突变患者的疗效优于其他DNA损伤修复突变及未经选择的患者。
小样本分析表明PD-1/PD-L1检查点抑制剂治疗DNA损伤修复基因突变(包含BRCA1/2或ATM)患者的疗效优于其他突变患者。但尚不明确本研究中对比HRD阳性患者,BRCA突变患者高应答率未转化为生存获益的原因。本研究未设置纳武利尤单抗或卢卡帕利单药治疗组,TRITON2研究中,卢卡帕利单药治疗化疗经治BRCA1/2突变阳性mCRPC患者的ORR为50.8%,PSA应答率为54.8,中位rPFS为8.5个月,这或许提示A1队列中纳武利尤单抗对于治疗获益的贡献极低。但需注意,不同研究的数据差异对比需仔细斟酌,考虑多种因素(研究设计,患者群体和特征)。例如TRITON2研究中患者仅接受一线紫杉类化疗,而A1队列中近1/3患者已经接受过两线紫杉类化疗。
尽管样本量较小,本研究中观察到非BRCA HRD阳性患者亦可从联合治疗中获益。队列A1携带ATM突变、CHEK2突变或CHEK2和FANCA共突变的患者观察到客观缓解或PSA缓解。队列A2中携带ATM突变或CHEK2突变的患者观察到客观缓解。与既往TALAPRO-1研究及TRITON2研究结果相一致,非BRCA1/2突变阳性,携带ATM或PALB2等与HRD相关的基因突变患者也可从联合治疗中获益。






