普拉替尼于2020年9月获得美国食品药品监督管理局(FDA)批准上市,用于RET融合阳性晚期非小细胞肺癌(NSCLC)的治疗。2021年3月24日,普拉替尼(商品名:普吉华®)获得中国国家药品监督管理局(NMPA)批准,用于既往接受过含铂化疗的RET基因融合阳性的局部晚期或转移性NSCLC成人患者,成为国内首个也是目前唯一获批的RET抑制剂,为我国RET融合阳性患者填补了治疗空白。肿瘤精准治疗时代下,小编来给大家盘点一下RET驱动基因的探索历程及临床转化。
RET基因是如何发现的?
RET基因最早于1985年由Takahashi等在转化培养的小鼠NIH3T3细胞中发现,位于人类10号染色体长臂上(10q 11.2),是一种原癌基因,其编码的蛋白是一种酪氨酸激酶受体[1]。
自从RET被发现以来的几十年里,研究发现了许多与其在癌症中的作用相关的信息。RET是神经胶质细胞源性神经营养因子(GDNF)配体家族的信号受体,这些配体在器官发育和组织稳态中起关键作用。
RET在癌症中是如何被异常激活的?
RET在癌症中异常激活的一般机制有三种:
1
框内RET基因融合[2][3]
2
RET基因本身的靶向突变[4-6]
3
RET基因的异常过表达[7][8]
这三种机制的共同点似乎是酪氨酸激酶的不适当激活,最常见的是在配体完全缺失的情况下。
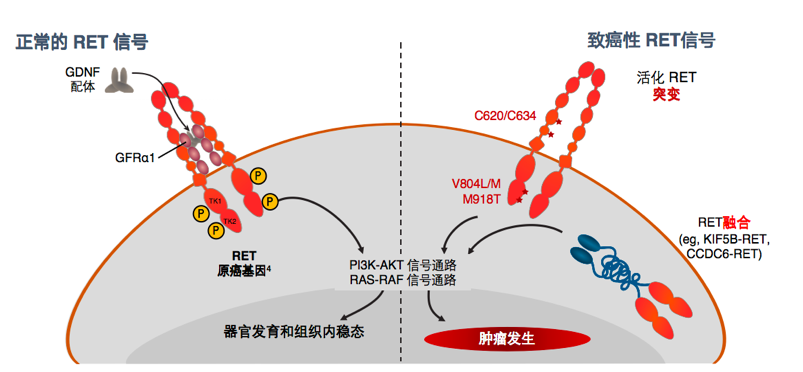
图1.RET信号异常可导致肿瘤发生
RET的靶向突变(例如RET M918T,V804M/L)通过三种广泛的机制导致异常激活-通过形成分子间半胱氨酸二硫键形成二聚作用,影响ATP结合结构域并最终增强激酶结构域活性。染色体重排(例如KIF5B-RET,CCDC6-RET)产生杂交蛋白,该杂交蛋白的融合伴侣通常包含一个RET激酶结构域的二聚体结构域。

图2.RET融合和突变均可使激酶活化,构成导致肿瘤发生的RET信号
RET突变的发生率因肿瘤类型而异!
RET融合常见于NSCLC(1-2%)和乳头状甲状腺癌(PTC,10-20%),而体系(60%-90%)或胚系(100%)RET突变见于甲状腺髓样癌(MTC)[9][10]。

恶性肿瘤中RET融合和RET突变的频率和分布
重点了解下:
1. RET融合比较常见于不吸烟、腺癌年轻患者;绝大多数的RET融合肺癌患者确诊时已处于晚期(III/IV期)[11],且RET融合NSCLC患者易发生脑转移[12]。
2. NSCLC中RET基因融合主要以KIF5B、CCDC6和NCOA4为主,而不同RET融合亚型NSCLC可能存在预后差异[11]。
3. RET基因融合在NSCLC中占有大约1-2%的频率,而且RET基因与其他驱动基因如EGFR、KRAS、ALK、HER2和BRAF是互斥的,很少同时出现,是一个独立的驱动基因;值得一提的是,RET融合阳性虽然在肺癌中比较少见,但研究显示许多TKIs耐药后都容易出现RET融合,因此该靶点是EGFR TKI获得性耐药机制之一,对于EGFR耐药患者,可再次进行RET检测[13][14]。
多靶点激酶抑制剂(MKIs)
治疗RET重排NSCLC的临床疗效


在RET融合阳性晚期NSCLC的治疗上,化疗的疾病控制时间只有5~6个月;此外,尽管几种多靶点激酶抑制剂(MKI)具有RET抑制活性,但是RET驱动的恶性肿瘤患者,尤其是RET融合阳性NSCLC患者,从具有继发性RET活性的多靶点激酶抑制剂中获益有限。虽然Vandetanib和Cabozantinib等MKI已获FDA批准用于晚期MTC的治疗,并已在RET融合阳性NSCLC患者中显示出活性,但与ALK或ROS1融合驱动的NSCLC的其他选择性激酶抑制剂相比,它们的应答率和反应持续时间较低[9][15-18],而RET选择性抑制剂的问世有望改变这一现状。
盘点RET抑制剂
治疗肺癌的新靶点
快速强效、持久缓解

NCCN指南关于RET重排阳性的用药推荐
1
普拉替尼(Pralsetinib)
Pralsetinib,商品名:Gavreto, 即BLU-667,由基石药业和战略合作伙伴Blueprint Medicines共同开发的一款口服RET抑制剂,2020年9月,普拉替尼获得美国食品药品监督管理局(FDA)的快速评审上市,而近期国内的获批使普拉替尼成为中国目前唯一获批的RET抑制剂。在普拉替尼Ⅰ/Ⅱ期全球注册临床研究——ARROW研究中,亚裔人群占了很大比重,达到33%。整体客观有效率(ORR)达到65%,其中既往已经接受过铂类化疗的患者ORR是61%,而初治患者的ORR高达73%,这和以往针对其他靶点的靶向药物疗效几乎相当。普拉替尼不良反应发生率比较低,大多是1~2级而且可控。普拉替尼的另外一个特点是颅内抗肿瘤活性高,因此对伴有脑转移的患者疗效非常好。

BLU-667在ASCO大会上公布的ARROW I / II 期临床试验数据
2
塞尔帕替尼(Selpercatinib)
Selpercatinib,商品名:Retevmo,即LOXO-292。2020年5月8日,礼来制药的Retevmo在美国获批上市,它是第一个被批准专门用于携带RET基因变异的癌症患者的靶向药。在RET阳性NSCLC的前期研究中,39例未接受过系统性治疗的RET融合突变NSCLC患者,使用LOXO-292以后,85%的患者肿瘤显著缩小。105位化疗后耐药进展的RET融合突变NSCLC患者,使用LOXO-292以后,64%的患者肿瘤再次显著缩小,81%的患者缓解持续时间至少为6个月。而且,塞尔帕替尼能够透过血脑屏障对脑转移病人效果显著。
3
多靶点激酶抑制剂(Multi-kinase inhibitors)
在LOXO-292和BLU-667上市之前,用于RET基因融合突变NSCLC患者的靶向治疗药物,主要为多靶点药物,如凡德他尼(Vandetanib)、卡博替尼(Carbozantinib)、舒尼替尼(Sunitinib),但上述药物整体对于RET基因融合突变的靶向特异性并不强,有效性相对较差,且副作用和非靶向毒性增加。
NSCLC患者如何精准用药
看看指南咋说?
NCCN非小细胞肺癌指南(2021.V4):
强烈建议对已有可及药物的罕见驱动突变进行检测

对于转移性的非鳞状NSCLC,NCCN NSCLC专家组目前推荐至少应检测如下标志物:EGFR突变、BRAF突变、ALK融合、ROS1融合、MET14外显子跳跃突变、RET重排及PD-L1表达。

NCCN NSCLC指南专家组强烈建议进行更广泛的分子谱检测,以鉴别有可及药物的罕见驱动突变,或就临床试验的可能性向患者提供适当的建议。
ESMO指南:关于RET融合或突变的检测建议
a.对于NSCLC、甲状腺非髓样癌(non-MTC)或其他实体肿瘤,在有可用福尔马林固定、石蜡包埋(FFPE)样本的情况下,需要检测RET融合筛选患者。如果NGS不可及,则在NSCLC和non-MTC中使用FISH或RT-PCR,这取决于肿瘤细胞的可用性、成本和/或数量。如果检测结果为阴性,建议进一步进行NGS panel检测。然而,值得注意的是,最近的ESMO建议使用多基因NGS来评估NSCLCⅠ级突变,包括RET融合。除了RET融合检测外,其他实体瘤患者可能还需要根据待定临床试验的结果进行RET突变检测,最好通过NGS来完成;如果NGS不可及,可以使用Q-PCR。在上述任何情况下,都不建议进行RET-IHC检测。
b. 对于NSCLC、non-MTC或其他实体瘤,其FFPE样本不可用或已用尽的情况下,建议进行液体活检以检测RET改变。值得注意的是,如果液体活检未检测到RET改变,则仍需进行肿瘤组织检测以进一步排除RET融合的可能性。
NSCLC中RET融合基因
检测现状如何?
融合基因的检测方法相对多样而复杂,目前可用于RET基因检测的方法包括免疫组化(IHC)、逆转录PCR(RT-PCR)、荧光原位杂交(FISH)、高通量测序(NGS)和循环肿瘤DNA(ctDNA)检测。而临床样本的类型、肿瘤细胞的多少和标本整体质量的好坏都是影响检测方法选择的重要依据。

检测RET重排技术的主要特点和优缺点
IHC
IHC在检测RET时假阳性率和假阴性率均较高,主要原因是目前没有特异性的RET抗体且IHC阳性值标准不统一,目前临床应用极少[19]。
RT-PCR
RT-PCR是目前检测RET融合的重要手段之一,通过RNA水平检测RET融合基因可大大提高检测效率,已广泛应用于RET筛查研究中,但它的缺点是只可以鉴定已知的RET融合伴侣。
FISH
3. RET基因融合在NSCLC中占有大约1-2%的频率,而且RET基因与其他驱动基因如EGFR、KRAS、ALK、HER2和BRAF是互斥的,很少同时出现,是一个独立的驱动基因;值得一提的是,RET融合阳性虽然在肺癌中比较少见,但研究显示许多TKIs耐药后都容易出现RET融合,因此该靶点是EGFR TKI获得性耐药机制之一,对于EGFR耐药患者,可再次进行RET检测[13][14]。
NGS
NGS可同时检测RET融合、SNVs和插入/缺失突变,提供丰富、精确的基因突变信息,即使肿瘤细胞在样本中比例较低时也可进行检测;并且RET和ROS1、ALK融合形式不太一样,从DNA层面上检测敏感性几乎可以达到100%,目前其缺点是数据庞大解读较复杂,且费用相对较高。
ctDNA
ctDNA是检测肿瘤变异的新手段,属于液态活检的一种。ctDNA主要来源于坏死或凋亡的肿瘤细胞、循环肿瘤细胞或者肿瘤细胞分泌的外泌体,含量较低(约占cfDNA的1%左右),ctDNA检测可作为组织标本实在不可得的情况下的补充,不可替代组织诊断。
划重点
目前在肺癌中需要检测的基因越来越多,而活检的样本量有限,协调组织诊断和分子病理检测,避免浪费样本对于提高检出率也具有重要意义。如果无法获取肿瘤组织,可以尝试进行ctDNA检测,研究表明ctDNA特异性可以接近100%,但是敏感性略差,存在假阴性。而ctDNA检测阴性的患者强调要尽可能再次进行组织检测。
整体而言,RET已经成为晚期NSCLC患者必检基因之一,临床检测意识的提高有助于让这部分患者从普拉替尼等靶向药中获得快速强效的临床获益。
此外,RET等罕见靶点的临床药物开发也促进了NGS等检测方法的发展和成熟。在RET新药研发临床实验中,采用了NGS、FISH、PCR等检测方法,辅助诊断或协助耐药机制的探索。液体活检与组织验证的一致性很高,且ctDNA的降低与患者的预后相关,或可成为反映预后的检验方法之一。
求臻医学大panel检测套餐
全面覆盖多个罕见驱动突变基因
求臻医学自主研发的599基因大Panel检测产品ChosenOne599®包含RET等多个罕见驱动突变基因检测,全面涵盖单核苷酸位点变异(SNV)、小片段插入/缺失(INDEL)、融合基因(Fusion)、拷贝数变异(CNV)等多种突变类型;同时求臻医学战略合作推广的Illumina公司的大panel检测产品CSO500,不但能够覆盖RET融合的DNA检测,还能覆盖该基因的RNA检测,降低基因融合漏检率,更准确识别罕见融合和未知融合,最大化助力肿瘤患者靶向治疗的选择和生存获益。
参考文献:






