由LRP1B基因编码的低密度脂蛋白受体相关蛋白1b是一种肿瘤抑制因子。LRP1B突变的肿瘤应用免疫治疗可能改善预后。本研究对接受ICIs治疗的LRP1B突变的多种肿瘤进行回顾性分析,发现LRP1B致病性/可能致病性突变携带者(P/LP组)应用ICIs后的PFS及OS较LRP1B临床意义未明突变携带者(VUS组)有明显改善。LRP1B基因突变状态可能成为预测免疫治疗疗效的独立预测生物标记物之一,提示临床阶段应充分重视LRP1B致病性突变或可能致病性突变的提示作用,这部分患者可以从免疫治疗中获益。
研究背景
免疫检查点抑制剂(ICIs)已成为非小细胞肺癌、黑色素瘤、肾癌治疗的首选,但并非所有患者均获益。PD-L1表达、MSI状态、TMB为FDA批准的免疫治疗疗效预测生物标记物。此外,肿瘤浸润淋巴细胞、免疫表型、炎症基因表达谱和肠道微生物群等等也具有不同程度的预测价值。
LRP1B基因编码低密度脂蛋白受体相关蛋白1b,也是潜在的免疫治疗疗效预测标志物之一。LRP1B位于2号染色体长臂,包含的外显子超过91个,包含50多万个碱基,是LDL受体家族的一员。既往研究认为LRP1B可能是肿瘤抑癌基因,受甲基化调控,在许多实体瘤和血液恶性肿瘤中发生突变或失活。LRP1B是人类最常见发生缺失突变的10个基因之一,体细胞LRP1B总体突变率为11.8%,在NSCLC、黑色素瘤、食管癌、胃癌、头颈部及泌尿系统肿瘤中突变频率更高,超过20%。一系列研究均表明LRP1B突变与ICI治疗后延长生存相关,但LRP1B突变是单纯的免疫治疗预后标志物还是独立于TMB和MSI的免疫治疗疗效预测标志物还未知。
研究方法
研究结果
入组人群

图1. 不同亚型人群的肿瘤类型分布
预后转归
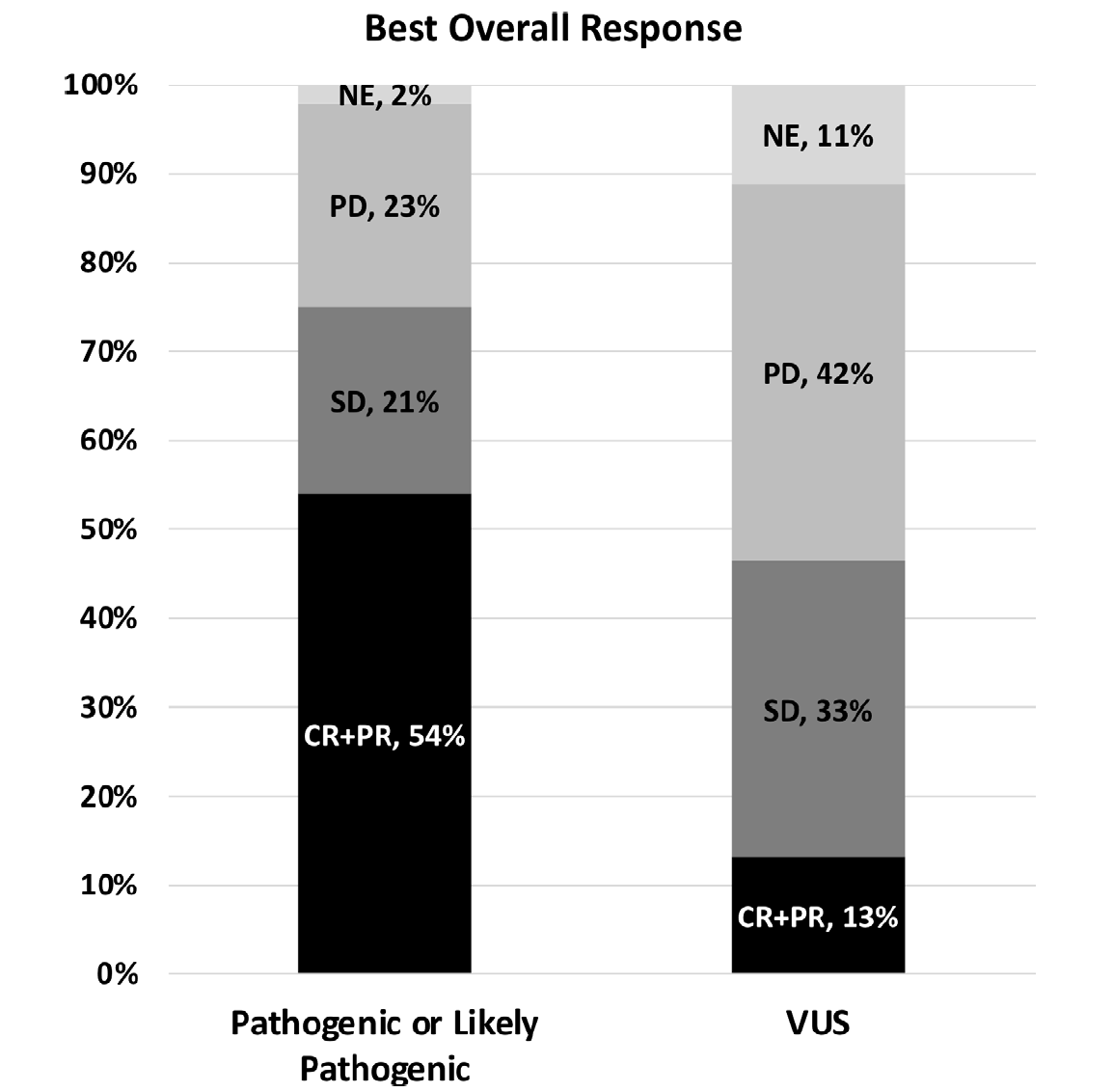
图2. 不同LRP1B分子亚型的最佳总体反应
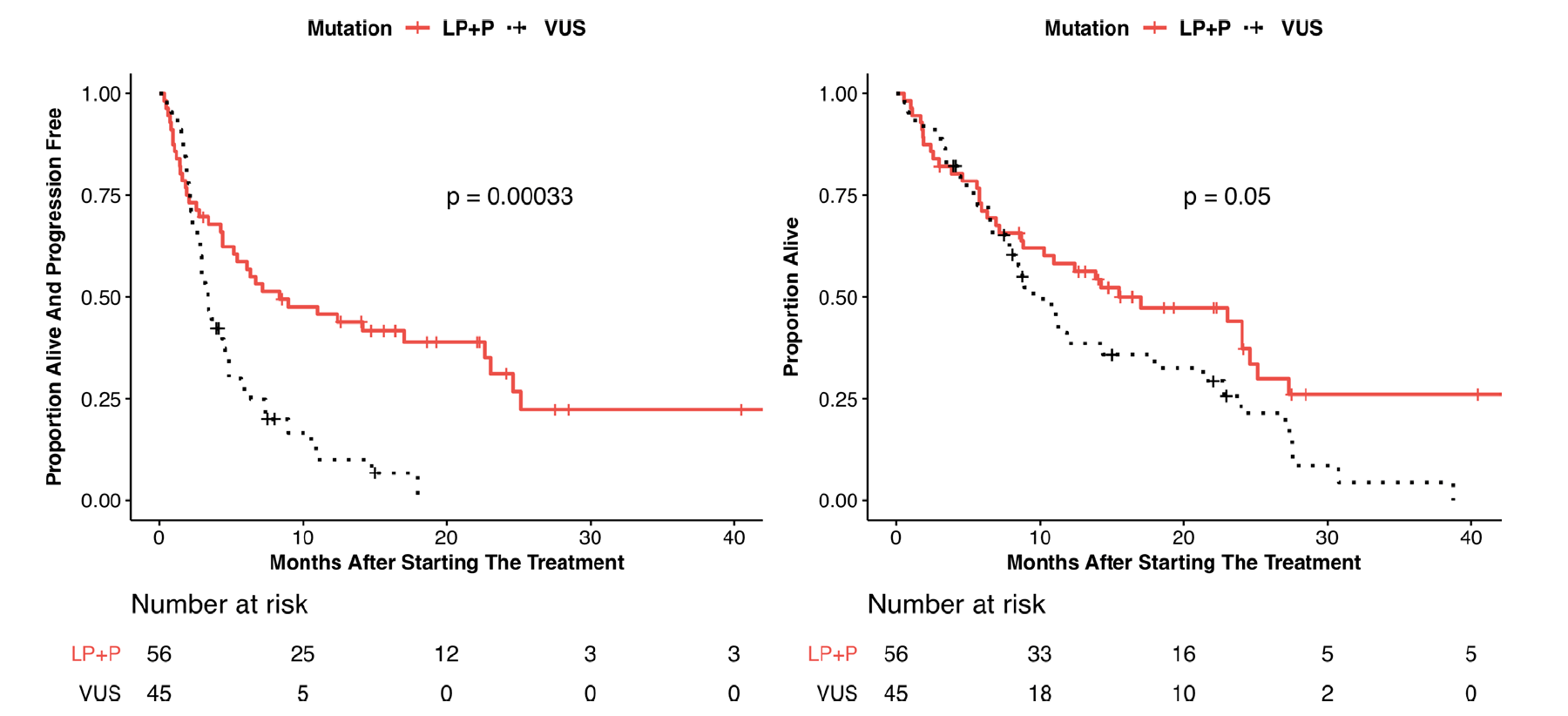
图3. P/LP组及VUS组的 PFS、OS
与TMB的关系
亚组分析接受
免疫治疗应答者相关分析
讨论
点评
ChosenOne599®泛癌肿基因检测方案






