近日,求臻医学与中南大学湘雅医院普外科合作,报道了一例伴有新的胚系NF1移码突变的多原发恶性肿瘤(1型神经纤维瘤、胃肠道间质瘤和小肠腺癌)患者,为深入分析NF-1、GIST和SBA之间的关系提供助力,目前该案例报道(case report)已在线发表于Frontiers in Oncology。

1型神经纤维瘤(NF-1)是一种常染色体显性遗传病,由17号染色体NF1基因突变引起,发病率为1/3000。NF1基因是肿瘤抑制基因,由57个组成型外显子和4个交替剪接外显子(9a、10a2、23a和48a)组成,约280kb。1型神经纤维瘤表现为多个扁平、浅棕色的皮肤色素斑块、皮肤皱褶、皮肤下可见的神经纤维瘤和Lisch结节,有时会出现严重的并发症,包括学习障碍、脊柱侧弯、骨质疏松和恶性肿瘤,进而影响身体的各个部位,严重影响患者的身心健康。只有出现症状的神经纤维瘤需要治疗。大型皮肤神经纤维瘤可以通过手术切除,而中小型神经纤维瘤可以在麻醉下用二氧化碳激光治疗。最新的治疗方法(如Cabozantinib)仍处于II期临床试验阶段。
胃肠道间质瘤(GIST)是起源于胃肠道中的起搏器细胞(也称为Cajal细胞)的间质瘤。GIST主要表现为腹痛、胃肠道梗阻和上消化道出血。
小肠腺癌(SBA)占小肠癌的40%,发病率为7.3/百万,主要发生在十二指肠、空肠和回肠。SBA通常伴有局部肿瘤并发症。十二指肠SBA通常与胃出口梗阻相关,其中1/4-1/3患者报告有胃肠道出血。小肠尽管占据了75%的胃肠道长度和90%的胃肠道粘膜表面,但是与结直肠癌相比,小肠腺癌的发病率较低,因此大多数治疗方法都是基于结直肠癌的治疗模型提出的。这种差异可能是由于小肠有较低的细菌载量,更快的食物流动和更多的肠道汁液稀释导致有害物质的暴露较少,丰富的淋巴结,较高的IgA水平和更好的免疫反应,进而导致APC突变的发生率较低。
在此,求臻医学与中南大学湘雅医院合作,报道了一例伴有新的胚系NF1移码突变的多原发性恶性肿瘤(NF-1、GIST和SBA),并探讨了三者之间的关联。
· 2022年6月30日:患者在另一家医院接受了结肠镜检查,结果显示回肠末端有多个圆形的肿块,直肠和结肠有小息肉。体检发现患者全身有神经纤维瘤、咖啡斑、皮肤皱褶(图1)。诊断为胃肠道肿瘤和1型神经纤维瘤。家族史调查显示,患者的两个儿子和孙女也患有神经纤维瘤(图2)。血常规、尿液、粪便、凝血功能、肿瘤标志物正常,粪便潜血试验阳性。胸部、腹部和骨盆检查的CT扫描显示一个末端回肠肿瘤,伴有继发性肠套叠、弥漫性骨质疏松症(继发性右侧第二肋陈旧性骨折伴骨痂形成)、双侧骶骨后方肿块、骶骨吸收。胸部、颈部、腹部和背部观有多个皮下结节(补充图1)。头部MRI未见异常。

图1(A–C)均显示NF1的症状:多个扁平、浅棕色的皮肤色素斑块、皮肤褶皱破坏、皮肤下可见的神经纤维瘤(A) 是(B,C)的母亲
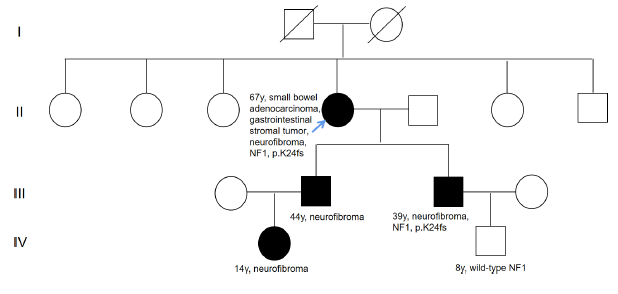
图2. 家族谱系。黑色符号表示1型神经纤维瘤;右上方的数字显示当前年龄;箭头表示先证者
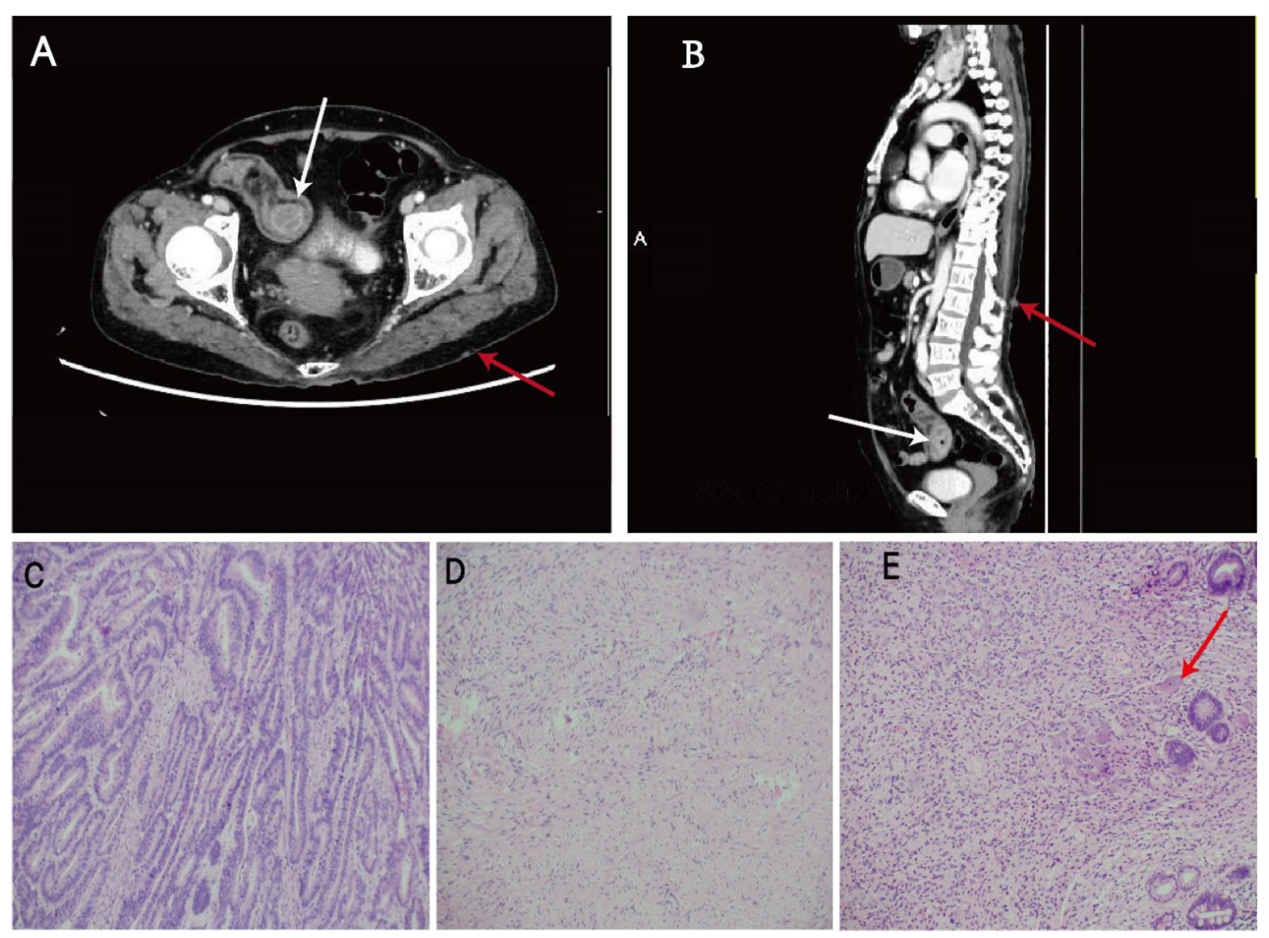
补充图1 CT和病理(H.E.染色)
A和B:小肠腺癌(白色箭头)和皮肤上或皮肤下的神经纤维瘤(红色箭头)
C:小肠腺癌
D:胃肠道间质瘤
E:神经纤维瘤
· 2022年7月4日:在全身麻醉下进行剖腹探查。术中在回盲区10cm范围内观察到有一大小约为5cm×7cm的肿块,近端小肠明显肿大和水肿。在距离Treitz 韧带约120cm的小肠侧壁上可见直径约1.5cm的肿块(补充图2)。切除回盲部肿瘤、相应的肠系膜和小肠侧壁上的肿块。
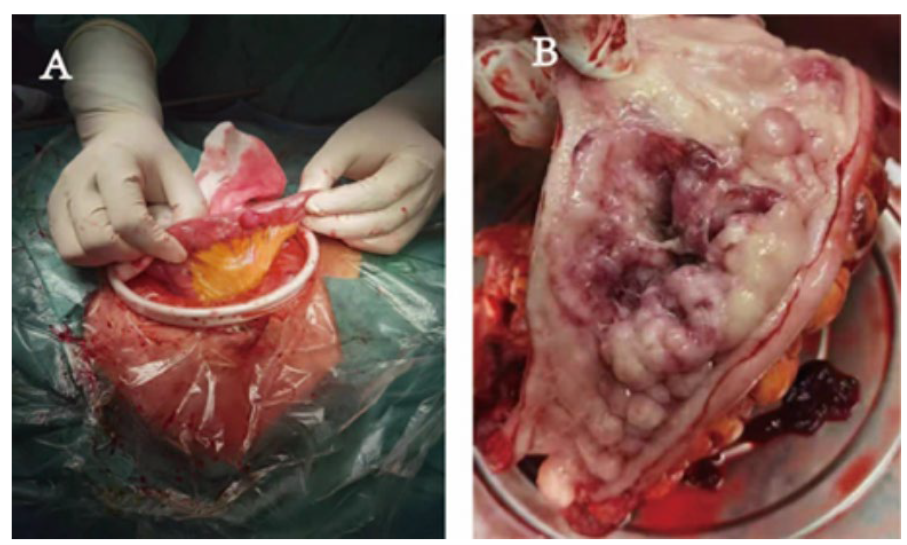
补充图2 手术中的肿瘤形态学
A:外生胃肠道间质瘤,大小约1.5cm
B:溃疡性小肠腺癌,长约7cm,伴有多发性肠神经纤维瘤
术后病理证实小肠回盲区肿块为中度分化腺癌(补充图1),侵犯浆膜下结缔组织,未转移至肠系膜淋巴结(0/15)。小肠侧壁上的肿物被诊断为胃肠道间质瘤,肿瘤最大直径为1.5cm,肿瘤包膜完整,有丝分裂计数≤5/5mm²,提示侵袭性较低。
先证者的术后顺利,未发现小肠腺癌的转移,也没有高风险特征(如切缘阳性、肿瘤穿孔、神经或淋巴血管浸润和组织学分化不良等)。此外,免疫组化结果显示错配修复缺陷(dMMR)。根据NCCN指南,该患者不需要化疗。建议术后的三年,每三个月复查一次。
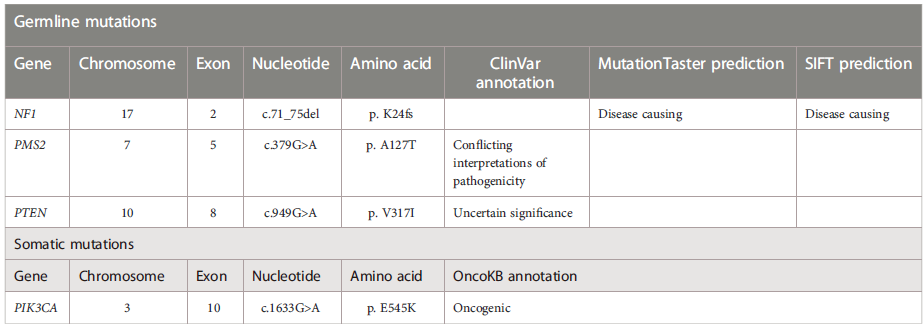
通过使用求臻医学自研ChosenOne®泛癌种大panel对先证者的SBA肿瘤组织和外周血进行高通量测序。检测结果显示,该患者有体系PIK3CA突变(NM_006218:exon10:c.1633G>a:p.E545K),突变频率为1.43%。检测结果还发现有新的NF1胚系移码突变(NM-000267:exon2:c.71_75del:p.K24fs),突变频率为45.51%。NF1的IGV截图如图3所示。此外,还检测到PMS2和PTEN错义突变(表1)。使用同一panel也对先证者的GIST肿瘤组织进行了NGS检测,结果显示除了相同的NF1移码突变(NM_000267:exon2:c.71_75del:p.K24fs),未检测到其他基因突变。
考虑到神经纤维瘤对几个家族成员的影响,使用遗传性肿瘤panel对该家族成员进行了基因测序。结果表明,先证者的小儿子(39岁,确诊为神经纤维瘤)的外周血中存在相同的NF1突变。先证者的孙子为野生型NF1(图3)。
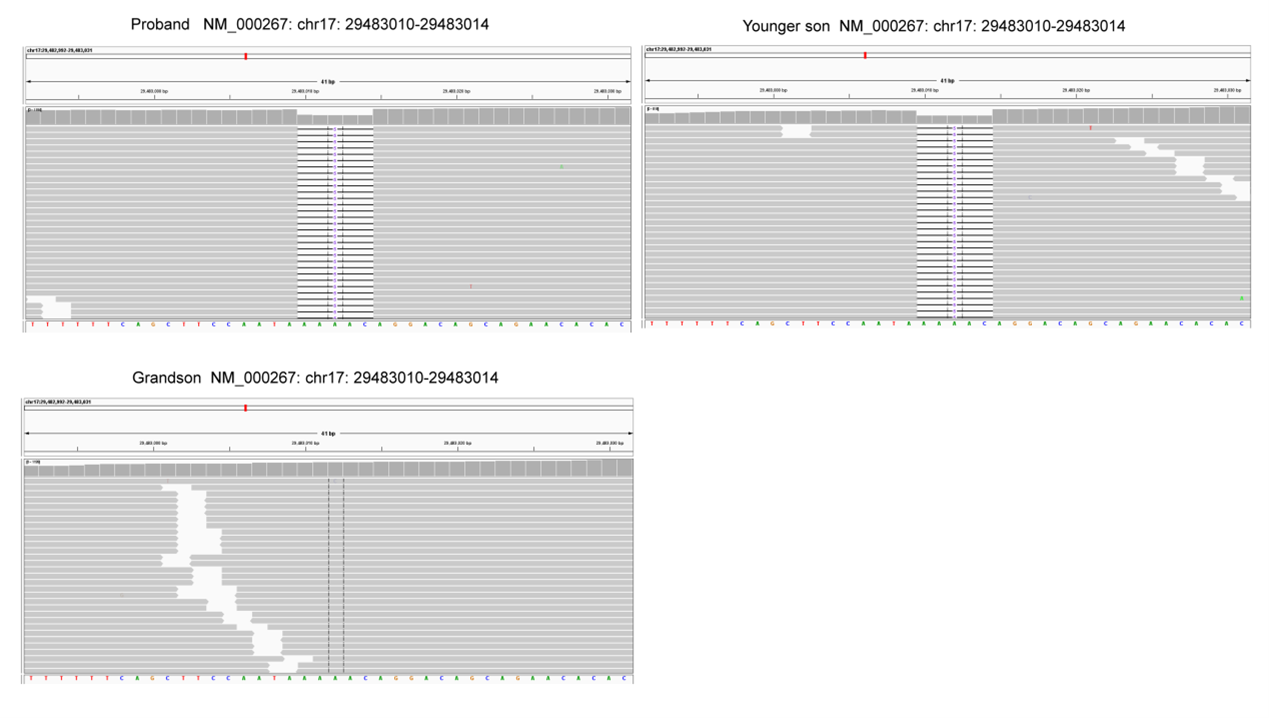
使用MutationTaster和SIFT软件预测该NF1突变具有致病性(表1)。该NF1突变可能是该家族聚集性NF1的致病原因。
神经纤维瘤是一种相对常见的常染色体显性遗传性疾病。NF1合并间质瘤的病例曾有零星的报道,但迄今未曾报道过同时患有NF-1、GIST和SBA的病例。
神经纤维瘤可被认为是一种肿瘤易感综合征,因为它会增加多发肿瘤的风险。芬兰的一项研究报告,NF1携带者在50岁时的累积癌症风险为38%,终生癌症风险为59.6%,而在普通人群中分别为3.9%和30.8%。NF1相关肿瘤包括恶性外周神经鞘肿瘤、胃肠腺癌、GIST、乳腺癌和嗜铬细胞瘤。
目前,约83%的GIST由KIT或PDGFRA基因突变引起。除PDGFRA-D842V突变外,患者普遍对imatinib的反应敏感。NF1相关的GIST与散发性GIST有显著区别:首先,散发性GIST主要分布在胃(50%-70%),而NF1相关的GIST多见于小肠(68%);大多数NF1相关的GIST为梭形细胞型(75%),预后优于散发性GIST。其次,NF1相关的GIST很少报道有KIT或PDGFRA突变。NF1相关的GIST恶性和风险较低,对imatinib具有耐药性,通常不需要治疗。NF1相关的GIST和散发性GIST之间可能存在共同的信号通路,即NF1基因突变破坏神经纤维蛋白的正常功能,并激活结构RAS,通过丝裂原激活蛋白激酶(MAPK)通路增加下游信号传导。RAS-MAPK级联的组成性激活也可能由KIT突变引起。因此,这一共同信号通路的激活导致了GIST的形成。
此外,还检测出先证者携带有PMS2基因的胚系突变c.379G>A(p. A127T)。小肠腺癌通常表现为dMMR。一项最大规模的关于SBA的回顾性研究在26%(26/100)的肿瘤中鉴定出了dMMR蛋白,其中在SBA中鉴定出10%(10/100)的林奇综合征,在dMMR肿瘤中鉴定出了38.5%(10/26)的林奇综合征。Schrock等人的研究发现,与胃癌(P=0.049)和结直肠癌(P<0.01)相比,SBA的NF1突变率更高。作为一种抑癌基因,NF1突变更可能导致SBA的发生。在这种情况下,基因分析可能有助于进一步揭示SBA和NF-1之间的关联。
求臻医学与中南大学湘雅医院合作,在一例多原发性恶性肿瘤(NF-1、GIST和SBA)患者发现了一种新的NF1胚系移码突变,这对分析NF-1、GIST和SBA之间的关系有一定帮助。如果NF1突变患者出现了胃肠道症状,应怀疑胃肠道肿瘤的可能性。另外建议针对该类患者进行基因检测,以制定相应的有效的治疗方案。
参考文献:
1. Gutmann DH, Ferner RE, Listernick RH, Korf BR, Wolters PL, Johnson KJ. Neurofibromatosis type 1. Nat Rev Dis Primers (2017) 3:17004. doi: 10.1038/nrdp.2017.4
2. Uusitalo E, Rantanen M, Kallionpaa RA, Poyhonen M, Leppavirta J, Yla-Outinen H, et al. Distinctive cancer associations in patients with neurofibromatosis type 1. J Clin Oncol (2016) 34(17):1978–86. doi: 10.1200/JCO.2015.65.3576
3. Wilson BN, John AM, Handler MZ, Schwartz RA. Neurofibromatosis type 1: New developments in genetics and treatment. J Am Acad Dermatol (2021) 84 (6):1667–76. doi: 10.1016/j.jaad.2020.07.105
4. Joensuu H. Gastrointestinal stromal tumor (GIST). Ann Oncol (2006) 17 Suppl 10:x280–6. doi: 10.1093/annonc/mdl274
5. Raghav K, Overman MJ. Small bowel adenocarcinomas–existing evidence and evolving paradigms. Nat Rev Clin Oncol (2013) 10(9):534–44. doi: 10.1038/nrclinonc.2013.132
6. Benson AB, Venook AP, Al-Hawary MM, Arain MA, Chen YJ, Ciombor KK, et al. Small bowel adenocarcinoma, version 1.2020, NCCN clinical practice guidelines in oncology. J Natl Compr Canc Netw (2019) 17(9):1109–33. doi: 10.6004/jnccn.2019.0043
7. Lowenfels AB. Why are small-bowel tumours so rare? Lancet (1973) 1 (7793):24–6. doi: 10.1016/S0140-6736(73)91228-2
8. Torpy JM, Burke AE, Glass RM. JAMA patient page. neurofibromatosis. JAMA (2009) 302(19):2170. doi: 10.1001/jama.302.19.2170
9. Philpott C, Tovell H, Frayling IM, Cooper DN, Upadhyaya M. The NF1 somatic mutational landscape in sporadic human cancers. Hum Genomics (2017) 11(1):13. doi: 10.1186/s40246-017-0109-3
10. Blay JY, Kang YK, Nishida T, von Mehren M. Gastrointestinal stromal tumours. Nat Rev Dis Primers. (2021) 7(1):22. doi: 10.1038/s41572-021-00254-5
11. Cassier PA, Fumagalli E, Rutkowski P, Schoffski P, Van Glabbeke M, Debiec-Rychter M, et al. Outcome of patients with platelet-derived growth factor receptor alpha-mutated gastrointestinal stromal tumors in the tyrosine kinase inhibitor era. Clin Cancer Res (2012) 18 (16):4458–64. doi: 10.1158/1078-0432.CCR-11-3025
12. Mussi C, Schildhaus HU, Gronchi A, Wardelmann E, Hohenberger P. Therapeutic consequences from molecular biology for gastrointestinal stromal tumor patients affected by neurofibromatosis type 1. Clin Cancer Res (2008) 14 (14):4550–5. doi: 10.1158/1078-0432.CCR-08-0086
13. Miettinen M, Fetsch JF, Sobin LH, Lasota J. Gastrointestinal stromal tumors in patients with neurofibromatosis 1: a clinicopathologic and molecular genetic study of 45 cases. Am J Surg Pathol (2006) 30(1):90–6. doi: 10.1097/01.pas.0000176433.81079.bd
14. Duensing A, Medeiros F, McConarty B, Joseph NE, Panigrahy D, Singer S, et al. Mechanisms of oncogenic KIT signal transduction in primary gastrointestinal stromal tumors (GISTs).Oncogene (2004) 23(22):3999–4006. doi: 10.1038/sj.onc.1207525
15. Ten Kate GL, Kleibeuker JH, Nagengast FM, Craanen M, Cats A, Menko FH, et al. Is surveillance of the small bowel indicated for lynch syndrome families? Gut (2007) 56(9):1198–201. doi: 10.1136/gut.2006.118299
16. Gallinger S, Aronson M, Shayan K, Ratcliffe EM, Gerstle JT, Parkin PC, et al. Gastrointestinal cancers and neurofibromatosis type 1 features in children with a germline homozygous MLH1 mutation. Gastroenterology (2004) 126(2):576–85. doi: 10.1053/j.gastro.2003.11.008
17. Latham A, Shia J, Patel Z, Reidy-Lagunes DL, Segal NH, Yaeger R, et al. Characterization and clinical outcomes of DNA mismatch repair-deficient small bowel adenocarcinoma. Clin Cancer Res (2021) 27(5):1429–37. doi: 10.1158/1078-0432.CCR-20-2892
18. Schrock AB, Devoe CE, McWilliams R, Sun J, Aparicio T, Stephens PJ, et al. Genomic profiling of small-bowel adenocarcinoma. JAMA Oncol (2017) 3(11):1546–53. doi: 10.1001/jamaoncol.2017.1051










