臻知识·专家访谈 | 第23期

近年来,MMR蛋白状态成为结直肠癌重要的临床分子标志物,与患者预后、晚期患者免疫治疗敏感性及林奇综合征等密切相关。既往的相关研究,更多围绕结肠癌患者展开,在直肠癌患者的临床应用中,dMMR能否体现出类似的临床意义值得关注。求臻医学特邀中国医学科学院肿瘤医院结直肠外科的汤坚强教授,结合近期发表在AMERICAN JOURNAL OF SURGICAL PATHOLOGY杂志上的文章进行解读。
汤坚强教授:dMMR/MSI-H这一分子标志物在结直肠癌等癌种的临床诊治中一直发挥着重要作用,在患者的预后评估、免疫治疗疗效预测以及林奇综合征判断等方面都有极其重要的参考价值。基于既往的研究工作,dMMR/MSI-H在结肠癌中的临床意义已非常明确,但基于直肠癌的研究相对较少,且部分结果存在争议。
本研究主要就dMMR在直肠癌中的两方面临床价值进行了探索性研究。一方面探讨了dMMR状态与林奇综合征的相关性,另一方面初步探索了dMMR状态对直肠癌新辅助治疗(包括新辅助放化疗及新辅助化疗)疗效的预测价值。该研究共纳入了368例接受新辅助治疗的直肠癌患者,收集了所有入组患者的MMR蛋白状态、新辅助治疗疗效评估数据及其他临床数据进行后续分析。经免疫组化证实,13例患者表现为MMR蛋白表达缺失,其中4例与新辅助治疗相关,最终共9例患者定义为dMMR状态,占总人群2.4%(9/368)。通过与病理学特征比较发现,相较于pMMR患者,dMMR患者肿瘤通常分级更高(33% vs 10%)、肿瘤浸润淋巴细胞更多(56% vs 3%)、更易出现周围神经浸润(44% vs 16%)。
经MMR基因及BRAF V600E基因测序分析发现,1例患者表现为MLH1/PMS2表达缺失合并BRAF V600E突变,定义为散发性患者;其余8例患者均检出MMR基因的致病性胚系突变,定义为林奇综合征;dMMR与林奇综合征的相关性达89%(8/9),dMMR患者的确诊年龄显著低于pMMR患者(中位确诊年龄:41 vs 60岁),这一结论也符合林奇综合征肠癌发病年龄低的特点。
通过分析新辅助治疗疗效与MMR蛋白状态,我们发现dMMR患者与pMMR患者在肿瘤退缩评分、肿瘤降期等方面存在显著差异。89%(8/9)的dMMR患者表现为肿瘤退缩评分3分,而pMMR患者中该比例仅为23%,相较于pMMR患者,dMMR患者在新辅助治疗后肿瘤降期概率显著较低(11% vs 57%)。多因素分析发现,较高的T分期、N分期和dMMR状态是直肠癌新辅助治疗疗效欠佳的独立预测因素,其中dMMR可导致新辅助治疗后肿瘤退缩评分为 3分的风险上升25.11倍。通过对368例患者进行长期随访发现,dMMR患者无病生存率显著差于pMMR患者(3年DFS率:67% vs 82%)。
本研究中,dMMR状态与林奇综合征的发生高度相关(89%),并且证实了其是直肠癌新辅助治疗疗效不佳的独立预测因素,这一结论可以很好的对临床实践工作起到提示价值。但在本研究中dMMR患者仅入组9例,需在接下来的工作中进一步扩大人群验证结论,其长期生存数据也有待进一步更新。此外,本次新辅助治疗方案主要为新辅助放化疗或化疗,有研究提示dMMR型直肠癌患者可获益于新辅助免疫治疗,未来期待积累更多这方面的数据和分子标志物用于指导直肠癌的个性化新辅助治疗。
摘要
本研究通过评估368例接受新辅助治疗的直肠癌患者的DNA错配修复蛋白状态、新辅助疗效、组织病理学特点以及生存数据,发现2.4%的直肠癌患者为错配修复缺陷(dMMR),其中89%的dMMR为LS相关,11%为散发性直肠癌。dMMR患者在新辅助治疗后较少出现肿瘤降期(11% vs 57%,P=0.007)。多因素分析亦提示较高的cT和cN分期和dMMR是新辅助治疗疗效欠佳的独立预测因素。其中dMMR可导致新辅助治疗后CAP肿瘤退缩评分为 3分的风险上升25.11倍。因此,MMR状态可帮助直肠癌患者预测新辅助治疗疗效,进而选择更精准的新辅助治疗方案。
研究背景
指南推荐局部晚期直肠癌患者进行新辅助治疗,然而不同患者对于新辅助治疗的应答存在显著差异,术后的治疗策略也会根据新辅助疗效发生变化,治疗后有明显肿瘤残留的需要进行全直肠系膜切除术,对于获得完全临床缓解的患者如果有器官保留需求可采取局部切除术或watch and wait策略。鉴别可用于新辅助治疗疗效预测的标志物可帮助指导直肠腺癌的个体化治疗,但到目前为止,尚缺乏有效预测标志物。
结肠癌中,DNA错配修复蛋白(MMR)缺陷(dMMR)及高度微卫星不稳定(MSI-H)是已知的与改善生存相关的预后因素;在转移性肿瘤中亦是免疫检查点抑制剂的疗效预测标志物。但直肠癌中dMMR的预后及疗效预测作用研究较少,且部分结果存在争议。
结肠癌中dMMR及MSI-H发生率约为15%,且大部分是由于MLH1体系突变导致的启动子甲基化引起的,这类肿瘤多伴发BRAF突变。小部分由Lynch综合征(LS)引起,来源于MMR基因(MLH1、MSH2、MSH6、PMS2)的胚系致病性突变,或出现胚系EPCAM 3’末端缺失进而导致MSH2基因的表观沉默。dMMR直肠癌中LS的发生率远高于结肠癌,但目前鲜有研究探索dMMR与直肠癌及LS的相关性。
研究方法
研究回顾性分析匹兹堡医学中心(UPMC)2010年至2020年之间接受新辅助治疗后序贯全直肠系膜切除术的原发浸润性直肠(中远端)腺癌患者。试验组为经免疫组化确认为dMMR的患者;对照组为错配修复正常(pMMR)的患者。新辅助治疗包括新辅助放化疗及新辅助化疗。
应用免疫组化检测患者MMR蛋白状态,4种蛋白均表达者为pMMR。MLH1、PMS2或MSH2表达缺失则为dMMR。MSH6表达缺失需要检测治疗前活检标本,表达缺失者为dMMR,表达者为pMMR。利用PCR法对MLH1/PMS2表达缺失患者进行BRAF突变检测,对野生型患者继续进行LS诊断评估。存在胚系MMR基因致病性变异或EPCAM缺失者为LS。
研究结果
dMMR常与LS相关
共368例经新辅助治疗及全直肠系膜切除术的直肠癌患者纳入研究。13例(3.5%)患者为MMR蛋白表达缺失,其中4例(1%)存在MSH6表达缺失,考虑与新辅助治疗有关。因此,共9例(2.4%)患者为dMMR(表1)。1例(表1,case 2)为MLH1/PMS2缺失合并BRAF V600E突变,为散发性MLH1缺陷。其余8例(100%)患者因MMR胚系致病性变异被确诊为LS。,因此,在9例dMMR患者中,89%为LS相关肿瘤。dMMR患者的年龄显著低于pMMR患者(中位确诊年龄:41 vs 60岁,P<0.001)(表2)。
表1. dMMR直肠癌患者的临床病理学特征
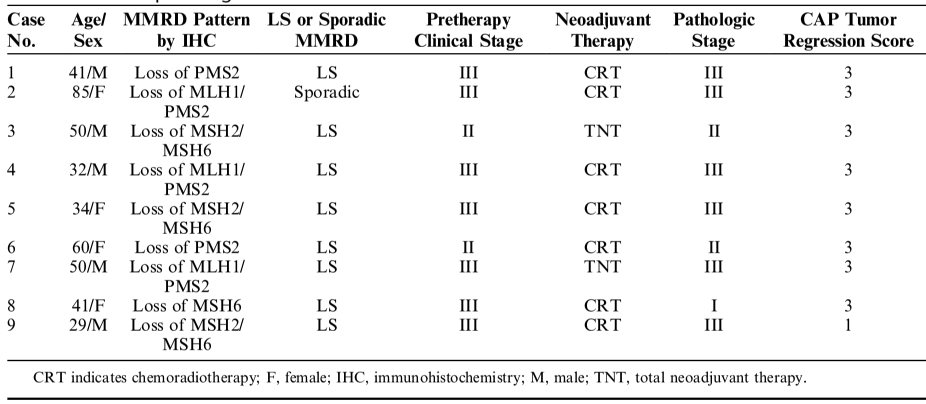
表2. 不同MMR状态患者的临床特征
dMMR与新辅助治疗疗效欠佳相关
接受新辅助治疗的患者中,64%的患者为III期,33%的患者为II期或I期(表2)。55%患者在新辅助治疗及手术切除后出现病理学分期下降,新辅助治疗后的患者分期比例为:I期29%、II期32%、III期31%。根据美国病理学家协会(CAP)标准进行肿瘤退缩评分,0分代表肿瘤完全应答,无残存肿瘤细胞;1分代表接近完全应答,有单个或少部分肿瘤细胞残留;2分代表部分应答,有由纤维化造成的残留病灶;3分代表无应答或应答较差,肿瘤无明显退缩并有大部分肿瘤残留。dMMR患者与pMMR患者肿瘤退缩评分存在显著差异(表2)。9例。89%(8/9)dMMR患者为CAP 肿瘤退缩评分3分,而pMMR患者中肿瘤退缩评分3分者为23%(P<0.001)。确诊LS的患者中,88%(7/8)为CAP肿瘤退缩评分 3分(图1、图2),1例散发性MLH1缺陷患者CAP肿瘤退缩评分 3分(表1)。并且dMMR患者在新辅助治疗后较少出现肿瘤降期(11% vs 57%,P=0.007)。
统计学分析表明,dMMR是直肠癌新辅助治疗反应欠佳的预后因素,多因素分析亦提示较高的cT和cN分期和dMMR是新辅助治疗疗效欠佳的独立预测因素。其中dMMR可导致新辅助治疗后CAP肿瘤退缩评分为 3分的风险上升25.11倍。
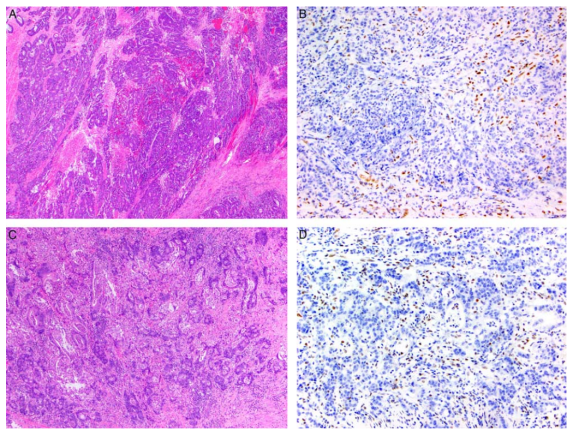
图1. A. (表1,case 4),32 岁男性,治疗前临床分期为III 期高级别腺癌,新辅助放化疗疗效欠佳(CAP 肿瘤退缩评分3分)。免疫组化显示肿瘤 MLH1 和 PMS2(B)表达缺失,患者存在胚系 MLH1 致病变异体。C. (表1,case 2)85 岁女性,治疗前临床分期为 III 期高级别腺癌,新辅助放化疗疗效欠佳(CAP 肿瘤退缩评分3分)。免疫组化显示肿瘤 MLH1 和 PMS2(D)表达缺失,PCR检测存在 BRAF V600E 突变,表明为散发性 MLH1 缺失。
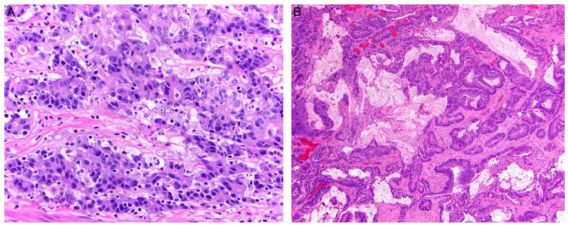
图2. A. dMMR直肠腺癌中肿瘤浸润淋巴细胞显著增多;B. dMMR 直肠腺癌在新辅助治疗后更易出现细胞外粘蛋白
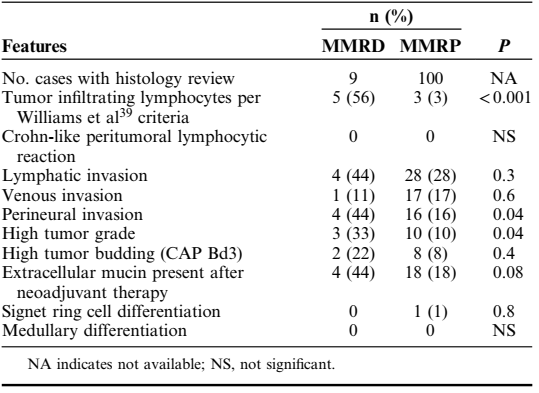
与dMMR相关的组织病理学特征
dMMR肿瘤通常分级更高(33% vs 10%, P=0.04)、肿瘤浸润淋巴细胞更多(56% vs 3%, P<0.001)、更易出现周围神经浸润(44% vs 16%, P=0.04)(表4)。
表4. 不同MMR状态患者的组织病理学特征
生存分析
对368例患者进行随访,病理分期为III期患者新辅助治疗后的DFS较0-II期患者显著缩短。CAP肿瘤退缩评分2-3分患者的DFS较0-1分患者显著缩短。与全直肠系膜切除术后R0患者相比,切缘阳性患者DFS显著缩短。
dMMR患者生存期较pMMR患者呈缩短趋势(3年DFS率:67% vs 82%,P=0.2)。多变量COX回归分析显示,与DFS呈显著相关的变量为病理分期III期(HR=2.46, P<0.001)、CAP肿瘤退缩评分2-3分(HR=3.44, P<0.001)及切缘阳性(HR=2.86, P=0.001)。
讨论
新辅助治疗是局部晚期直肠腺癌患者的标准治疗,对新辅助治疗的应答是重要的预后标志物。本研究提示dMMR是新辅助治疗疗效欠佳的独立预测因素,新辅助治疗后CAP 肿瘤退缩评分为 3分的风险增加25倍。dMMR直肠肿瘤与LS显著相关,89%的患者携带胚系致病性突变并最终被确诊为LS。
不同研究报道的直肠癌dMMR或MSI-H发生比例不一致,本研究中dMMR发生率为2.4%,与既往两项大型临床研究的比例接近,但是也有几项研究报道的dMMR/MSI-H发生比例较高(7.7%、7.9%、6.5%,etc.),这些研究均没有在MSH6缺失的情况下进一步评判该缺失是否由新辅助治疗导致。本研究中,3.5%的患者存在MMR蛋白缺失,但1%的患者是由新辅助治疗诱导的MSH6缺失并没有被判别为dMMR。仅有2项研究专门对dMMR直肠癌进行了胚系突变的鉴定,最终被确诊为LS的比例分别为84%和74%,本研究中dMMR的LS发生率更高,为89%,进一步说明dMMR直肠癌与LS高度相关。
本研究中无论新辅助放化疗或新辅助化疗组中,dMMR患者均应答较差,但是并未观察到MMR状态与生存之间的相关性,可能是由于dMMR直肠癌发生比例低且本研究中dMMR患者少不足以发现两组生存之间的差异。由于回顾性研究性质,只纳入了新辅助治疗后进行全直肠系膜切除术后的患者,并未纳入采取watch-and-wait策略的患者,且dMMR患者数较少,仍需进一步大规模,多中心的前瞻性研究进行验证。同时建议评估治疗前活检标本的MMR状态,有助于判断新辅助治疗的疗效,为患者提供更精准的治疗方案。






