
近年来,伴随肿瘤靶向、免疫、核素治疗的发展,泌尿肿瘤领域取得长足进步。特别是以基因检测为代表的精准医学在泌尿肿瘤中的广泛应用,正在快速改变泌尿肿瘤领域诊疗模式。求臻医学聚焦重磅研究,紧追前沿热点,对泌尿肿瘤领域前沿进展进行梳理,特推出“探泌臻知”系列栏目。上期我们了解到遗传性前列腺癌的易感人群、遗传相关基因及治疗策略,本期,求小臻将带领大家学习靶向治疗在前列腺癌中的应用,一起先睹为快吧。

同源重组修复基因缺陷与PARP抑制剂

同源重组修复(Homologous Recombination Repair,HRR)是DNA双链断裂的首选修复方式,当DNA出现双链断裂,同源重组修复相关酶通过对DNA同源链进行重组,完成双链损伤部位的修复。当HRR基因突变引起同源重组修复缺陷(Homologous Recombination Deficiency,HRD)时,DNA双链损伤无法及时修复,损伤累积,最终导致细胞死亡。目前已知的同源重组修复基因包括BRCA1/2、ATM、ATR、BARD1、CHEK2、PALB2、RAD51、MRN等至少16种之多,而在前列腺癌中,HRR基因突变的发生率可达27.9%,是前列腺癌重要的驱动突变。
聚腺苷二磷酸核糖聚合酶(poly ADP-ribose polymerase,PARP)是修复DNA单链损伤的DNA修复酶。当PARP抑制剂竞争性结合PARP酶之后,抑制PARP酶发挥修复作用,导致DNA单链损伤无法及时修复,进而引起双链损伤。此时若同源重组修复正常,则双链损伤得以修复,弥补单链损伤修复不足。若此时同源重组修复基因缺陷,则双链损伤无法修复,最终引起肿瘤细胞死亡(图1)。
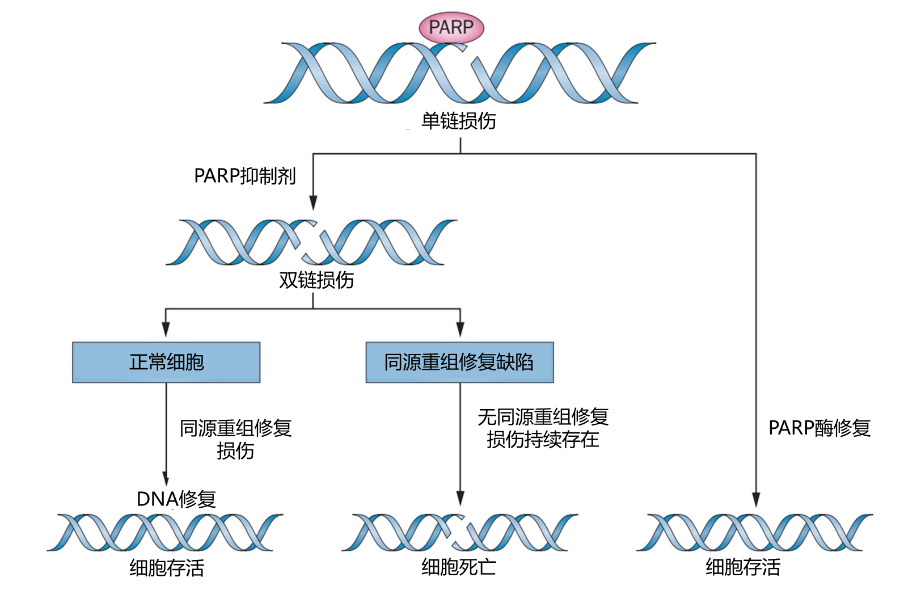
图1. PARP抑制剂作用机制[1]
目前PARP抑制剂已经开发出多达7种,国内常见的PARP抑制剂包括奥拉帕利、尼拉帕利、氟唑帕利、帕米帕利以及他拉唑帕利。其中奥拉帕利基于PROfound临床研究[2,3]获得美国FDA批准,用于阿比特龙或恩扎芦胺治疗进展后、携带HRR基因(中国NMPA批准为BRCA1/2)突变的转移性去势抵抗性前列腺癌(mCRPC)。
该研究显示对于HRR基因突变的mCRPC患者,一线经过新型内分泌治疗进展后使用奥拉帕利可显著改善患者的无疾病进展生存和总生存(图2)。而卢卡帕利和尼拉帕利则分别通过TRITON-2和GALAHAD研究[4,5],获得美国FDA“突破性疗法”认证,用于化疗和AR抑制剂治疗进展后携带BRCA1/2突变的mCRPC患者。随着国产PARP抑制剂氟唑帕利和帕米帕利的推出,使得靶向治疗成为了mCRPC治疗不可或缺的手段之一。
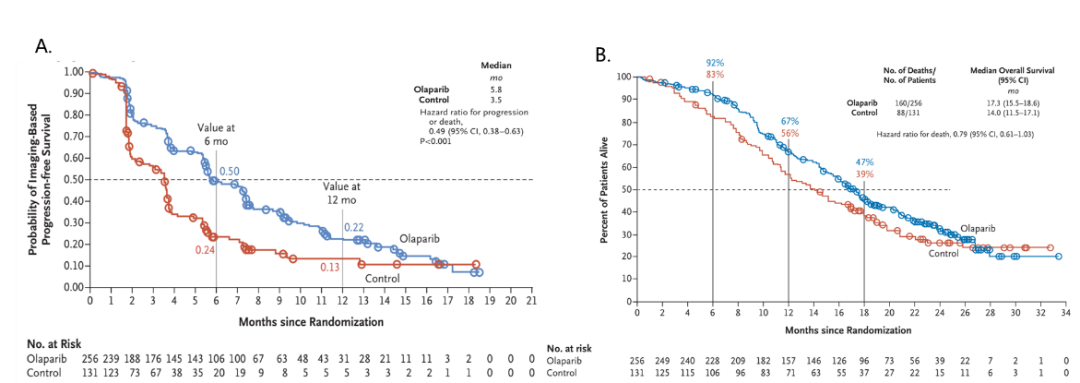
图2. 奥拉帕利治疗携带有HRR基因突变患者的疗效. (A)影像学无疾病进展时间;(B)总生存时间
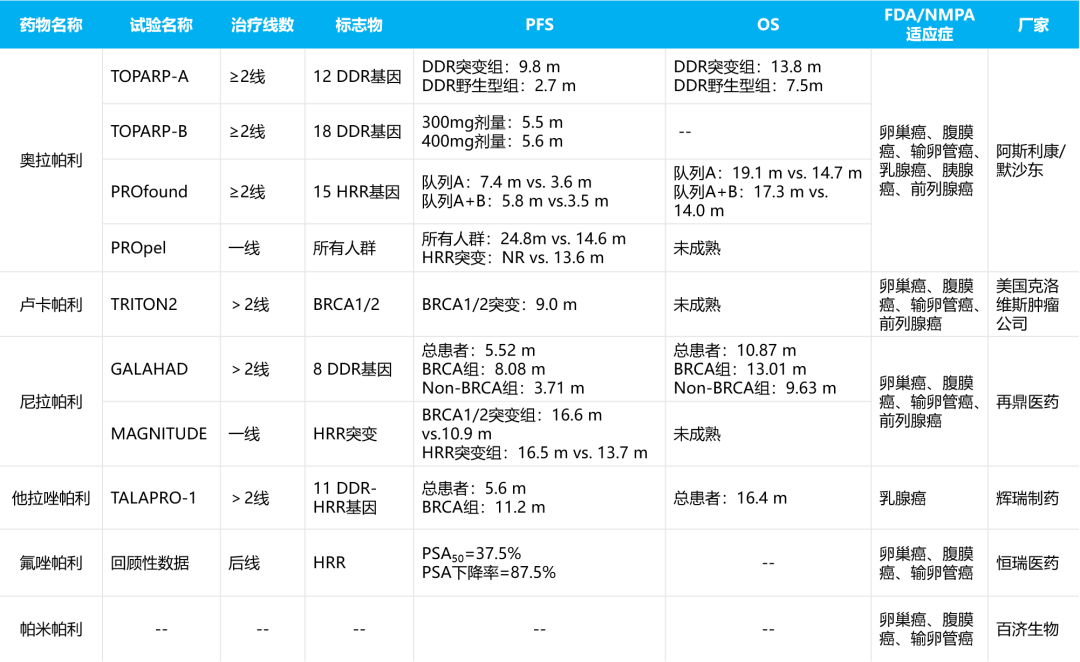
近年来随着研究的不断深入,研究人员发现新型内分泌治疗与PARP抑制剂之间存在协同作用,AR信号通路可诱导HRR突变状态,而PARP抑制剂可协助抑制AR信号通路。基于此,奥拉帕利联合阿比特龙的PROpel研究和尼拉帕利联合阿比特龙的MAGNITUDE研究也取得了重大进展。在今年的ASCO-GU上相继报道了PROpel和MAGNITUDE的研究成果,显示出联合治疗具有显著的临床优势,且HRR突变的患者获益更大(表1)。
表1. PARP抑制剂重要临床试验与数据
基于以上研究,无论是国外的NCCN指南、EAU指南,还是国内的CSCO指南和前列腺癌诊疗指南,均推荐晚期mCRPC患者进行HRR基因检测,指导PARP抑制剂用药,为晚期前列腺癌提供更加精准的治疗决策。
PI3K-AKT信号通路与AKT抑制剂

PI3K-AKT信号通路是细胞生物学中的重要信号通路,与肿瘤的增殖、侵袭密切相关,其中PIK3CA、PTEN、AKT1是PI3K-AKT信号通路的重要成员。有研究报道,前列腺癌中PI3K-AKT相关基因突变发生率可达30%,且PI3K-AKT相关基因突变与前列腺癌的预后不良、内分泌治疗及新型内分泌治疗疗效较差有关。目前临床上已经开发出针对PI3K-AKT信号通路的ATK抑制剂帕他色替(Ipatasertib)和Capivasertib(AZD5363),用于抑制PI3K-AKT信号通路激活,抑制肿瘤的生长。
帕他色替是AKT的小分子抑制剂,可以抑制AKT蛋白的三种亚型,进而抑制PI3K-AKT信号通路。2021年7月,Lancet在线发表了帕他色替联合阿比特龙一线治疗mCRPC的III期研究成果[10],该研究纳入1101例未经新型内分泌治疗和化疗的mCRPC患者(激素敏感期接受化疗的患者可以纳入),按照1:1随机分配为帕他色替联合阿比特龙+波尼松治疗组(N=547)和阿比特龙+波尼松组(N=554)。
结果显示,对于mCRPC患者一线接受帕他色替联合阿比特龙+波尼松治疗可以改善患者的PFS(联合治疗组vs. 对照组=19.2 m vs. 16.6 m,HR=0.84,p=0.043,但是未达到预设的统计学差异)。而经过预设标志物分析发现,对于含有PTEN蛋白缺失的mCRPC,帕他色替联合阿比特龙+波尼松显著改善患者的PFS(联合治疗组vs. 对照组=18.5 m vs. 16.5 m,HR= 0.77, p=0.034)。进一步分析NGS突变数据发现,无论是PTEN突变还是PIK3CA/AKT1/PTEN突变的患者,帕他色替联合阿比特龙治疗获益更显著(图3)。因此对于PTEN、PIK3CA、AKT1突变的mCRPC,帕他色替联合阿比特龙+波尼松可能成为其治疗的重要选择。
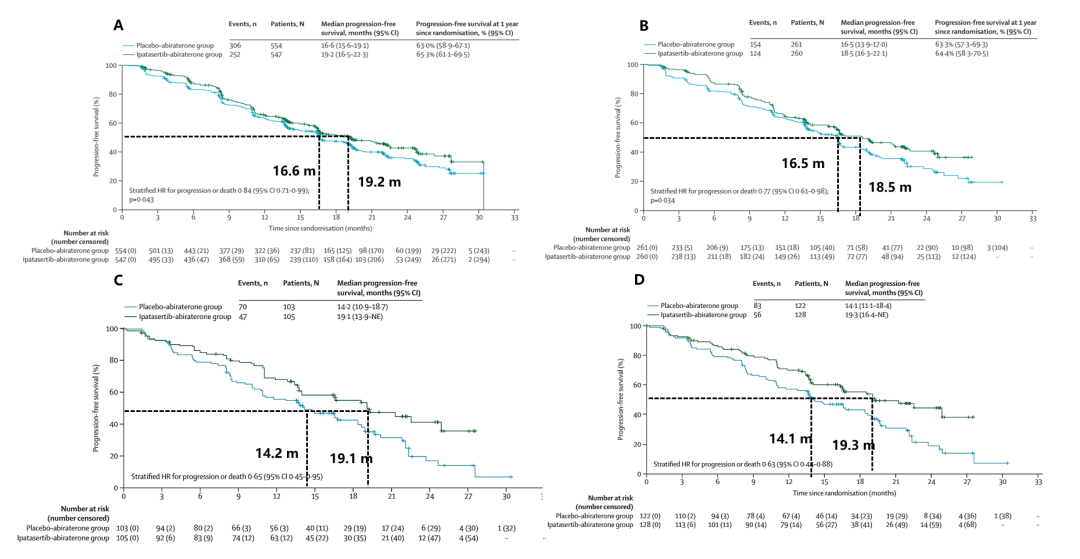
图3. 帕他色替联合阿比特龙对比阿比特龙一线治疗mCRPC.(A)所有人群;(B)PTEN蛋白缺失人群;(C)PTEN突变组;(D)PIK3CA/AKT1/PTEN突变组
Capivasertib也是AKT的小分子抑制剂,已经在乳腺癌的治疗中取得重大突破,而在前列腺癌治疗中也表现出一定抗肿瘤活性。2020年 Journal of Clinical Oncology在线发表了Capivasertib联合多西他赛治疗新型内分泌治疗进展后mCRPC的II期研究结果[11],研究显示,对于经过新型内分泌治疗进展后的mCRPC,Capivasertib联合多西他赛治疗可延长患者的OS(治疗组 vs. 对照组=31.15 m vs. 20.27 m, HR=0.54, p=0.01),但是未延长患者的PFS(治疗组 vs. 对照组=7.03 m vs. 6.70 m, HR=0.92, p=0.32)。标志物分析显示,对于PIK3CA、PTEN和AKT突变的患者,结果相似。因此,对于Capivasertib治疗mCRPC的疗效仍需大规模的III期研究进行进一步验证。
细胞周期抑制剂与前列腺癌治疗

细胞周期调控是控制细胞增殖、分裂的关键,常见的调控蛋白包括直接调控的细胞周期蛋白依赖性激酶(CDKs),比如CDK4、CDK6、CDK12以及参与调控的RB1、MYC、AURKA等相关基因。研究显示,对于晚期CRPC患者,细胞周期调控相关基因发生突变的频率增高,尤其RB1、MYC、AURKA等基因的突变,与神经内分泌分化前列腺癌密切相关,因此细胞周期抑制剂相关治疗可能为晚期mCRPC尤其可能发生神经内分泌分化前列腺癌带来希望。
目前细胞周期抑制剂主要为针对CDK4/6的抑制剂,比如哌柏西利、瑞博西利,并且在乳腺癌、高分化和去分化脂肪肉瘤中,已经取得相应的适应症。2022年4月,Clinical Cancer Research在线发表了瑞博西利联合多西他赛和波尼松治疗mCRPC的Ib/II期研究[12],该研究共纳入43例经治的晚期mCRPC患者,首先Ib期入组13例患者进行药物剂量爬坡试验,瑞博西利从200mg到400mg/d,多西他赛从60 to 75 mg/m2,最终推荐剂量定为400mg/d瑞博西利第1-4天和8-15天用药,多西他赛60mg/ m2治疗。后续入组30例患者进行II期放大试验,结果显示,瑞博西利联合多西他赛和波尼松治疗mCRPC的中位rPFS达到8.9个月,6个月rPFS率为65.8%,ORR达到30.8%。而对25例可评估PSA患者进行分析,PSA50达到32%,其中两例下降超过90%,bPFS达到7.15个月。瑞博西利联合多西他赛在治疗晚期mCRPC患者,取得良好的疗效。进一步通过CTC标志物分析发现,对于CDK6、MYC未突变的患者,获益更大,提示对于瑞博西利的使用,需要在标志物的指导下进行。
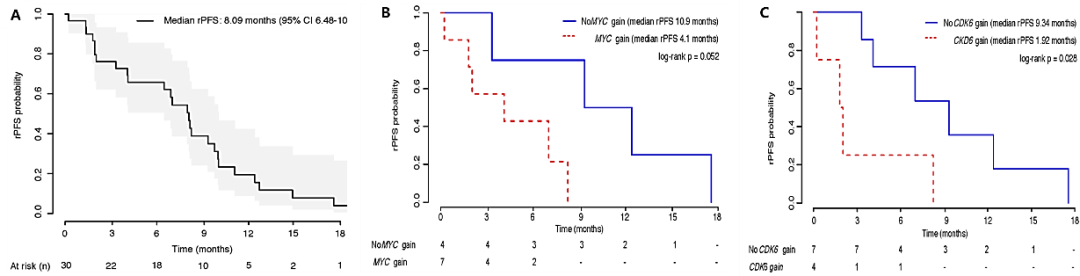
图4.瑞博西利联合多西他赛治疗mCRPC.(A)影像学无疾病进展时间;(B)MYCN扩增与疗效;(C)CDK6扩增与疗效
阿利色替(alisertib)是针对细胞周期调节相关蛋白AURKA的小分子抑制剂,可以抑制AURKA蛋白的活性,而AURKA与前列腺癌神经内分泌分化有着密切关系。在一项II期临床研究中[13],研究者通过入组神经内分泌或者伴神经内分泌分化的前列腺癌,给予阿利色替50mg 每天两次,服药一周停两周,评估阿利色替治疗神经内分泌或者伴神经分泌分化前列腺癌的疗效。研究筛选75例患者,最终入组治疗60例,其中45例明确为明确神经内分泌分化,15例为腺泡腺癌,结果显示中位PFS仅为2.0个月,中位OS为7个月。通过分子标志物分析显示,AURKA、MYCN扩增比例均为16%,而AURKA扩增的患者OS获益显著。对于AURKA的小分子抑制剂治疗晚期CRPC尤其伴神经内分泌分化前列腺癌仍需进一步的探索。
总 结

随着对前列腺癌发生发展的分子机制认识越来越深入,前列腺癌治疗领域进展也日新月异,相信未来将会有更多靶向药用于前列腺癌的治疗,从而造福更多的前列腺癌患者。

求臻医学
泌尿系列肿瘤基因检测方案
求臻医学从临床诊疗痛点出发,与泌外科顶级专家团队开展深度合作,结合最新研究进展深度打磨泌尿系列专属产品,全面覆盖前列腺癌、膀胱癌、肾癌等泌尿肿瘤多个治疗阶段,满足临床不同需求;同时针对患者疾病诊疗史进行个体化精准解读,辅助临床治疗决策;作为《中国肿瘤基因图谱计划》(CGAC)项目的转化成果,该系列产品定制化设计了国内外泌尿肿瘤高频突变基因panel,紧跟泌尿前沿贴近中国临床实践;通过指导肿瘤精准用药、疗效监控及健康管理提供全面有效的参考信息,为泌尿肿瘤患者保驾护航!






