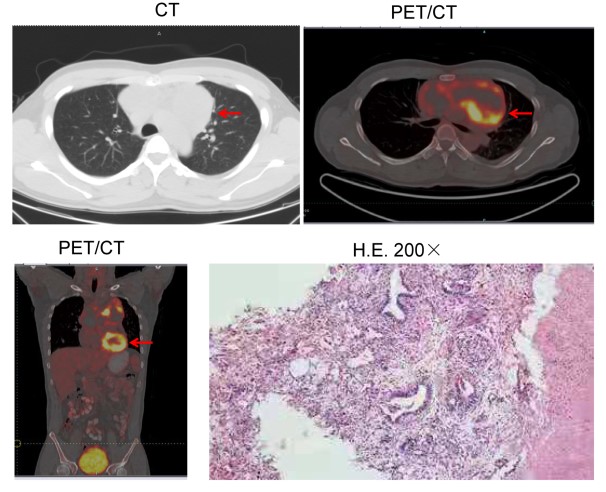
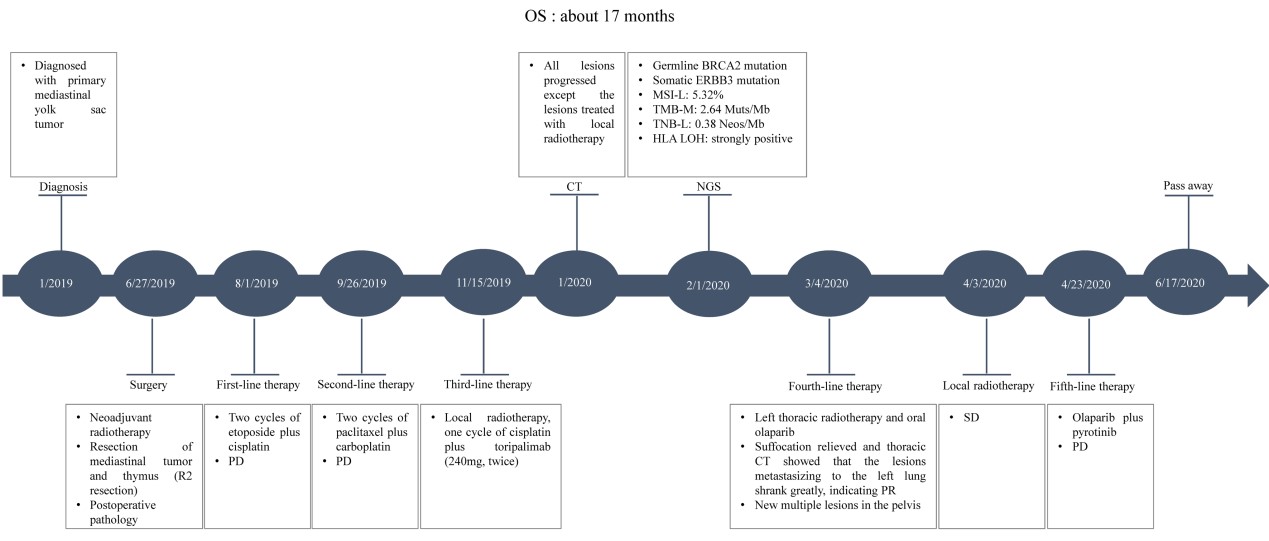
近日,求臻医学与青岛市中心医院放疗科张小涛主任合作,首次报道了一例有BRCA2胚系移码突变(NM_000059.3:exon11: c.4563_4564delAT: L1522fs)的难治性转移性纵隔卵黄囊瘤患者对局部放疗有显著反应。目前该案例报道(case report)已在线发表于Cancer Biology & Therapy(IF:4.742)。 研究背景 卵黄囊瘤,即内胚层窦瘤,是发生在卵黄囊内的高度侵袭性生殖细胞肿瘤。根据位置,可分为性腺卵黄囊瘤和性腺外卵黄囊瘤。性腺外卵黄囊瘤相对少见。它们通常发生在身体的中轴,如大脑、纵隔和腹膜后。纵隔卵黄囊瘤在婴儿期和青春期后更常见。 目前,卵黄囊瘤的标准治疗方案是博莱霉素(Bleomycin)、依托泊苷(Etoposide)和顺铂(Cisplatin)(BEP)化疗后进行手术。然而,由于恶性程度高,诊断时不可能完全切除,原发性纵隔卵黄囊瘤的预后极差,5年生存率为40%-50%,复发后仅仅有6个月的生存期。 过往研究表明,原发性纵隔卵黄囊瘤患者对化疗反应良好,但对放疗反应较差。据报道,某些病例对放射治疗敏感。 然而,目前对原发性纵隔卵黄囊瘤精准放疗的预测性生物标志物尚未被探索。 DNA损伤修复(DDR)对恶性和正常细胞的生存都至关重要。临床前数据显示,辐射敏感性与DDR有关。近期研究表明,DDR基因突变可能预测多种实体瘤患者对放疗敏感性增强。 本案例报告了一例难治性转移性原发性纵隔卵黄囊瘤男性患者。当患者接受化疗,同时使用或不使用特瑞普利单抗(Toripalimab, PD-1抗体)时,疾病进展迅速。然而,该患者对局部放疗很敏感。通过全外显子组测序(WES)在患者体内检测到了BRCA2胚系移码突变。 病例分享 上下滑动查看所有内容 病例讨论 放疗在纵隔卵黄囊瘤的治疗中起着至关重要的作用。为了最大限度地从放疗中获益,探索与疗效相关的生物标志物至关重要。以往的研究证明,包括BRCA1/2在内的DDR基因突变可能会增强多种实体瘤患者的放射敏感性。然而,DDR基因突变作为原发性纵隔卵黄囊瘤放疗的预测性生物标志物尚未被探索。 放射敏感性取决于多种因素,例如肿瘤组织学、辐射剂量和肿瘤细胞的固有放射敏感性等。其中肿瘤细胞的内在放射敏感性是最重要的因素。由于放疗主要通过产生DNA双链断裂(DSB)诱导细胞死亡,DDR无疑会影响肿瘤细胞的放射敏感性。 DDR系统通过八条途径修复多种形式的DNA损伤,以适当保护基因组的完整性。这八条途径包括错配修复(MMR)、碱基切除修复(BER)、核苷酸切除修复(NER)、同源重组修复(HRR)、非同源末端连接(NHEJ)、检查点因子(CPA)、范科尼贫血(FA)和易位DNA合成(TLS)。其中HRR和NHEJ通路负责修复DSB, BER负责修复单链断裂(SSB),MMR通路负责修复DNA插入/缺失。 BRCA1和BRCA2是介导HRR途径的两个关键分子。这两个基因的突变可能会破坏DSB的修复。由于辐射主要通过产生DNA双链断裂诱导细胞死亡, BRCA1或BRCA2突变的恶性肿瘤通常会导致HRR通路的缺陷,因此对电离辐射反应良好。 目前纵隔卵黄囊瘤的标准治疗方案是新辅助化疗后将残余肿块切除术。由于确诊时肿瘤通常巨大且常与邻近器官有纤维粘连,化疗后残余肿瘤的完全切除非常困难,也间接导致了本病较差的预后。新辅助化疗是纵隔卵黄囊瘤的主要治疗方法,初始治疗方案推荐以铂为基础的化疗,常用方案为4-6个周期的VIP(顺铂、依托泊苷和异环磷酰胺)或BEP。含铂方案化疗使高达50%的患者实现了长期生存。我们检索到了许多新辅助化疗后R0切除及术后达到病理学完全缓解(PCR)的报道。对于化疗和手术后复发的纵隔卵黄囊瘤患者,再次化疗的效果很差。本例患者对化疗不敏感,原因尚不明确。 此外,患者对免疫检查点抑制剂(ICI)治疗不耐受。可能与患者MSI-L、TNB-L和HLA LOH强阳性有关(表1)。HLA LOH强阳性意味着HLA-A、B和C三个基因同时缺失。HLA LOH是免疫逃逸的常见原因。这是由于抗原提呈细胞通过HLA I类分子的抗原提呈新抗原在细胞免疫中起着关键作用。HLA-LOH导致抗原呈递减少,从而促进了免疫逃逸。 此前的研究表明,BRCA1突变的携带者患乳腺癌、卵巢癌、前列腺癌和结肠癌的风险增加,而BRCA2突变的携带者患男性乳腺癌、胰腺癌和前列腺癌的风险更高。目前卵黄囊瘤的发病机制尚不清楚。然而,该患者的BRCA2胚系移码突变应该与其病因密切相关。BRCA2胚系突变导致负责DSB修复的HRR通路缺陷。 PARP抑制剂可能抑制PARP-1介导的SSB修复(即BER通路),从而增加DNA链断裂的积累,促进基因组不稳定性和细胞凋亡。根据合成致死率的概念,PARP抑制剂可以有效地摧毁BRCA基因缺陷的肿瘤以及同源重组能力较低的睾丸肿瘤细胞系。迄今为止,FDA已批准奥拉帕利用于治疗BRCA胚系突变的卵巢癌、乳腺癌和前列腺癌。此外,奥拉帕利在治疗BRCA胚系突变的胰腺癌和小细胞肺癌(SCLC)方面也表现出显著的临床疗效。 此外,Yue Bi等人的一项研究表明,奥拉帕利作为一种有效的放射增敏剂,在BRCA1缺陷型高级别浆液性卵巢癌的临床前模型中具有潜在的应用价值。这使我们联想到PARP抑制剂可能被用作潜在的放射增敏剂,以提高BRCA2突变患者的放疗敏感性。正如所料,本案例中的患者对局部放疗联合奥拉帕利治疗表现出良好的反应。 结论与启发 该病例报告首次描述了一例BRCA2胚系移码突变的难治性转移性纵隔卵黄囊瘤患者对放疗具有显著反应,可为临床实践中的精确放疗提供有见地的线索。
「文章发表」一例携带胚系BRCA2移码突变的难治性转移性纵隔卵黄囊瘤患者对局部放疗有显著反应
时间:2022-05-20
来源:求臻医学