TMB作为一个新兴的生物标志物,在大量临床研究中发现其与多种肿瘤的免疫治疗疗效具有相关性,越来越受到临床重视。但在dMMR/MSI-H型结直肠癌患者中TMB的指导价值尚不明确。求臻医学特邀湖北省肿瘤医院放疗中心皮国良教授,结合近期发表在European Journal of Cancer杂志上的文章进行解读。
皮国良教授:指南推荐免疫检查点抑制剂(ICI)用于错配修复缺陷(dMMR)/微卫星高度不稳定(MSI-H)的转移性结直肠癌(mCRC),但这部分患者仅占5%左右,且高达30% dMMR/MSI-H患者在使用免疫治疗后仍出现疾病早期进展。使用预测性生物标志物提前筛选出能获益于特定ICI治疗的MSI-H mCRC有助于改善患者生存。虽然dMMR/MSI-H型mCRC普遍TMB较高,但具体数值仍存在较大差异,TMB可能是潜在的预测性生物标志物。今天分享的这篇文章,旨在探索TMB在dMMR/MSI-H mCRC患者接受抗PD-(L)1单抗单药治疗或联合抗CTLA-4单抗治疗的指导价值。
本研究回顾性分析110例接受抗PD-1/PD-L1单抗联合/不联合抗CTLA-4单抗治疗的dMMR和/或MSI-H mCRC患者。其中,27.3%患者接受抗PD-(L)1和CTLA-4单抗联合治疗,其余患者接受抗PD-(L)1单抗单药治疗。41.8%患者接受免疫一线治疗。dMMR/MSI-H状态由免疫组化和/或PCR方法确定。TMB通过NGS 检测方法进行检测,中位TMB为49 mut/Mb。
研究结果显示TMB≤23 mut/Mb患者的PFS(aHR=4.26,p=0.001)及OS(aHR=5.14,p=0.003)显著较差。对于TMB>40 mut/Mb患者,接受抗PD-(L)1单抗和抗CTLA-4单抗联合治疗的获益显著优于抗PD-(L)1单抗单药治疗(2年PFS率:100% vs 70.7%,p=0.002;2年OS率:100% vs 76.0%,p=0.025)。但在TMB≤40 mut/Mb患者中则未观察到此现象。较低TMB与dMMR/MSI-H型 mCRC患者接受免疫治疗的早期疾病进展相关,而较高TMB患者可能从抗CTLA-4/PD-1免疫联合治疗中最大化获益。
总之,TMB可用于筛选双免联合治疗的最大获益人群,例如在TMB> 40mut/Mb患者中接受抗PD-(L)1和抗CTLA-4单抗联合治疗的CR率和ORR较抗PD-(L)1单抗单药治疗显著提高,且与100%的无事件生存相关。相反,TMB中等水平患者在接受抗PD-(L)1单抗基础上,联合抗CTLA-4单抗则无类似结果,还可能产生不必要的毒副作用。同时无论是抗PD-(L)1单抗单药治疗,还是联合抗CTLA4单抗治疗,TMB低(TMB≤23 mut/Mb)的患者接受免疫治疗后的预后均较差。本研究提示利用TMB数值可对dMMR/MSI-H mCRC患者不同ICIs治疗策略的获益进行分层,指导患者用药方案选择,最大化患者获益。
摘要
免疫检查点抑制剂(ICIs)是错配修复缺陷(dMMR)/高度微卫星不稳定性 (MSI-H)转移性结直肠癌(mCRC)的标准治疗。肿瘤突变负荷(TMB)是预测其免疫治疗疗效的潜在生物标志物。本研究纳入110例接受抗PD-(L)1单抗单药或抗PD-(L)1单抗和抗CTLA-4单抗联合治疗的dMMR /MSI-H型mCRC患者,结果显示TMB≤23 mut/Mb患者的PFS(aHR=4.26,p=0.001)及OS(aHR=5.14,p=0.003)明显较差。对于TMB>40 mut/Mb患者,接受抗PD-(L)1单抗和抗CTLA-4单抗联合治疗的获益显著优于抗PD-(L)1单抗单药治疗(2年PFS率:100% vs 70.7%,p=0.002;2年OS率:100% vs 76.0%,p=0.025)。但在TMB≤40 mut/Mb患者中则未观察到此现象。较低TMB与dMMR/MSI-H型 mCRC患者接受免疫治疗的早期疾病进展相关,而较高TMB患者可能从抗CTLA-4/PD-1免疫联合治疗中最大化获益。
研究背景
指南推荐dMMR/MSI-H型mCRC接受免疫治疗,但这部分患者仅占5%左右。多项关键研究显示这部分患者接受抗PD-1单抗治疗的长期PFS率高达 30–50%,联合抗CTLA-4治疗的长期PFS率可提升到50-70%。尽管大部分dMMR/MSI-H型mCRC患者对免疫治疗有持续应答并能够长期控制疾病,但高达30%患者仍出现疾病早期进展。提前利用预测性生物标志物筛选出可从ICIs治疗中获益的MSI-H mCRC患者将代表临床实践的重大进步。
在目前的新兴生物标志物中,TMB已被证实与多个癌种患者接受ICIs治疗的疗效相关。区别于MSS mCRC肿瘤,MSI-H/dMMR肿瘤以较高的TMB及移码突变负荷为特征。但dMMR/MSI-H mCRC患者之间的TMB存在高度异质性,不同TMB水平患者接受ICI治疗的预后不尽相同。本研究探索TMB在dMMR/MSI-H mCRC患者接受抗PD-(L)1单抗单药治疗或联合抗CTLA-4单抗治疗的指导价值。
研究方法
本研究回顾性分析来自意大利三个医学中心、接受抗PD-1/PD-L1单抗联合/不联合抗CTLA-4单抗治疗的dMMR和/或MSI-H mCRC患者。dMMR /MSI-H状态由免疫组化和/或PCR方法确定。TMB通过NGS 检测方法进行检测。
研究结果
患者基线特征
2016年1月至2022年2月,研究共入组110例患者。患者及疾病基线特征见表1。27.3%患者接受抗PD-(L)1和CTLA-4单抗联合治疗,其余患者接受抗PD-(L)1单抗单药治疗。41.8%患者接受免疫一线治疗。中位TMB为49mut/Mb。分别有89.1%原发灶及10.9%转移灶肿瘤组织进行NGS检测。
表1. 患者基线特征
TMB的预后作用
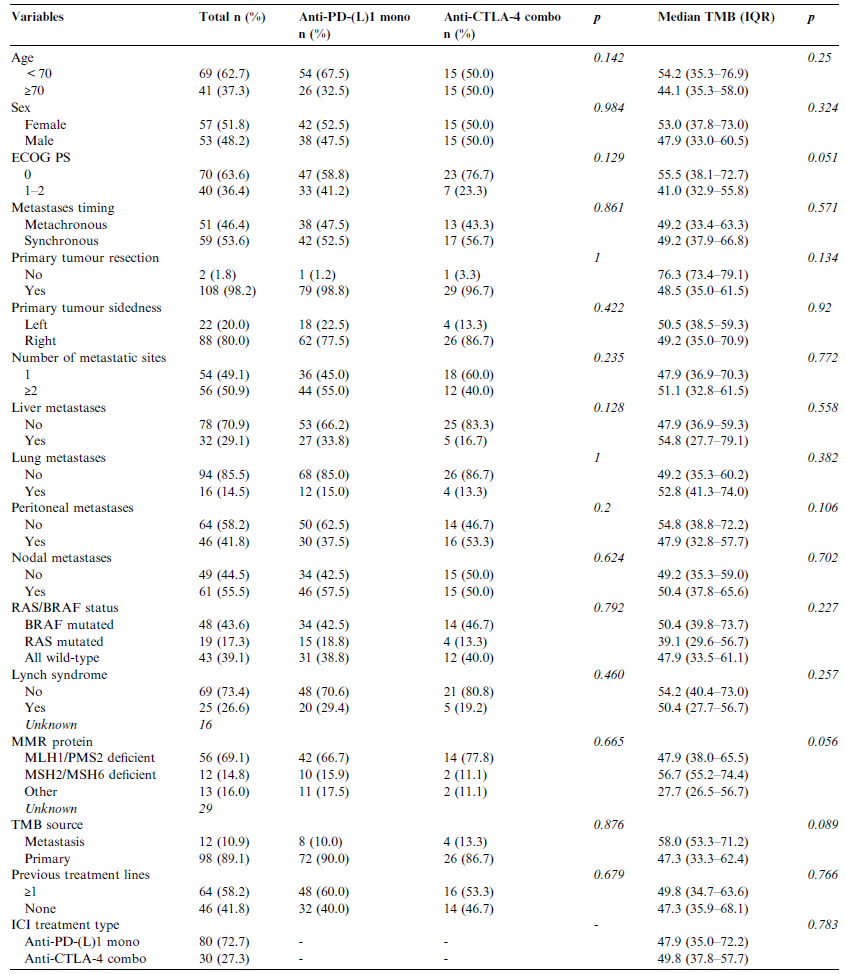
中位随访时间为26.8个月。图1表示不同ICI治疗类型的PFS及OS生存曲线。通过TMB进行PFS预后评估的最佳cut-off值为23 mut/Mb。基于此cut-off值,10%患者被纳入TMB-L组(≤23 mut/Mb),90%为TMB-H组(> 23 mut/Mb)。TMB-L患者的PFS及OS均劣于TMB-H患者(中位PFS:13.4个月vs未达到,HR=4.72,p<0.001;中位OS:25个月vs未达到,HR=3.36,p=0.019)(图2)。
通过单变量及多变量分析评估基线不同临床病理特征和PFS和OS的相关性,仅在多变量分析中发现TMB及ECOG PS评分状态与PFS及OS显著相关。值得注意的是,Lynch综合征患者PFS及OS均较散发性肿瘤患者有所延长,但无统计学差异。
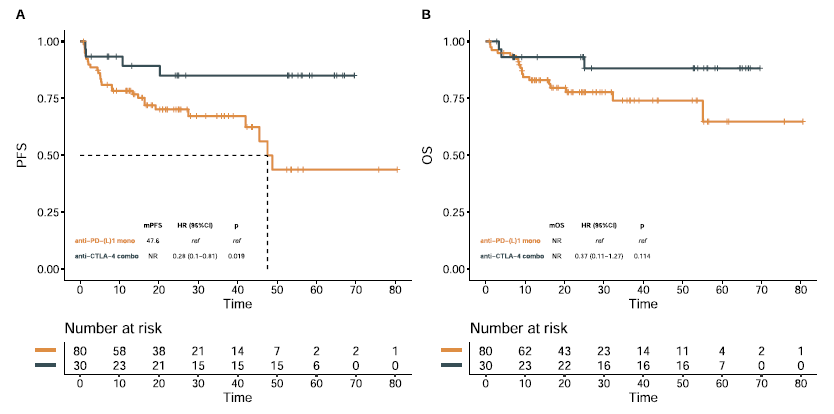
图1. 不同ICIs治疗类型的PFS(A)及OS(B)
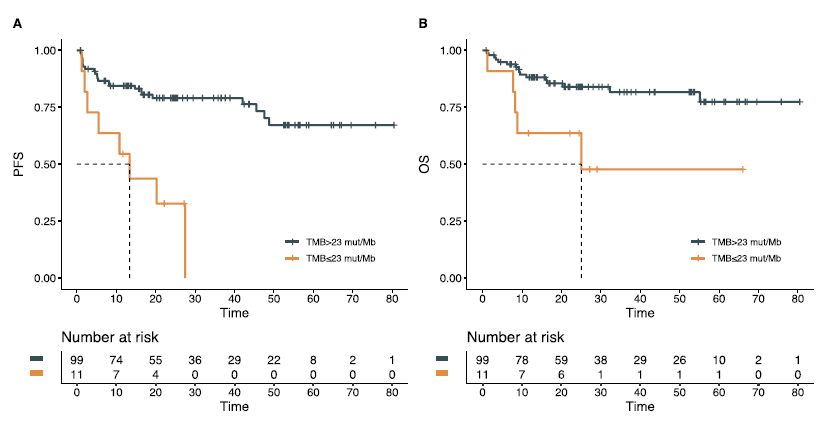
图2. TMB cut-off值为23 mut/Mb时,患者的PFS(A)及OS(B)
TMB与特定免疫治疗方案的相关性
研究继续探索TMB对于不同ICI治疗方案获益亚组人群筛选的指导价值。预测PFS的最佳TMB cut-off值为40 mut/Mb。与抗PD-(L)1单抗单药治疗相比,联合抗CTLA-4单抗治疗可显著延长TMB> 40 mut/Mb患者的PFS(2年PFS率:100.0% vs 70.7%,p=0.002)。但TMB≤40 mut/Mb患者中则无此现象(2年PFS率:59.7% vs 68.6%,p=0.888)(图3A)。OS结果亦如此(TMB> 40 mut/Mb患者2年OS率:100.0% vs 76.0%,p=0.025;TMB≤40 mut/Mb患者2年OS率:80.0% vs 81.0%,p=0.949)(图3B)。并且接受抗CTLA-4单抗联合治疗的TMB-H患者中均无肿瘤进展或死亡。
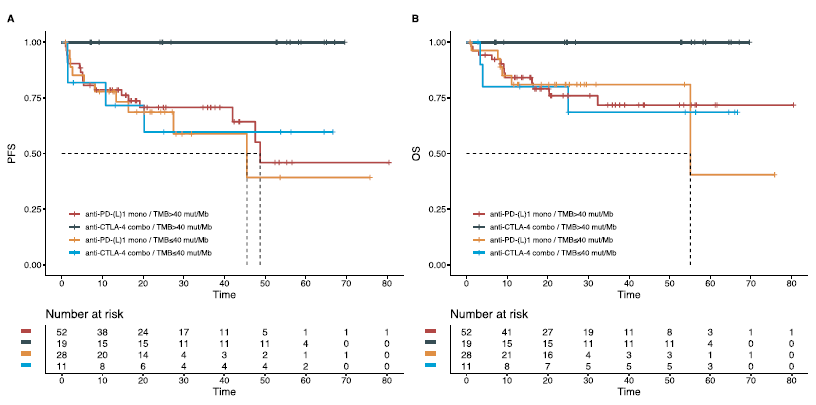
图3. 不同治疗类型及TMB cut-off为40mut/Mb时患者的PFS(A)及OS(B)
不同TMB状态患者接受ICI治疗后的肿瘤应答
共100例患者被纳入ORR分析。双免联合治疗患者的CR率及ORR均高于免疫单药治疗患者(CR率:36.7% vs 12.9%,OR=3.92,p = 0.009;ORR:83.3% vs 57.1%,OR=3.75,p = 0.016)(图4A)。与TMB ≤23的患者相比,TMB>23 mut/Mb患者的CR率及ORR均更高(CR率:22.0% vs 0%,p=0.198;ORR:OR=4.28,p=0.050)(图4B)。TMB>40 mut/Mb,接受抗CTLA-4单抗联合治疗患者的CR率及ORR为最高(图4C)。治疗方案及TMB状态相互作用对于CR率(p = 0.0438)及ORR (p = 0.054)均具有统计学意义。
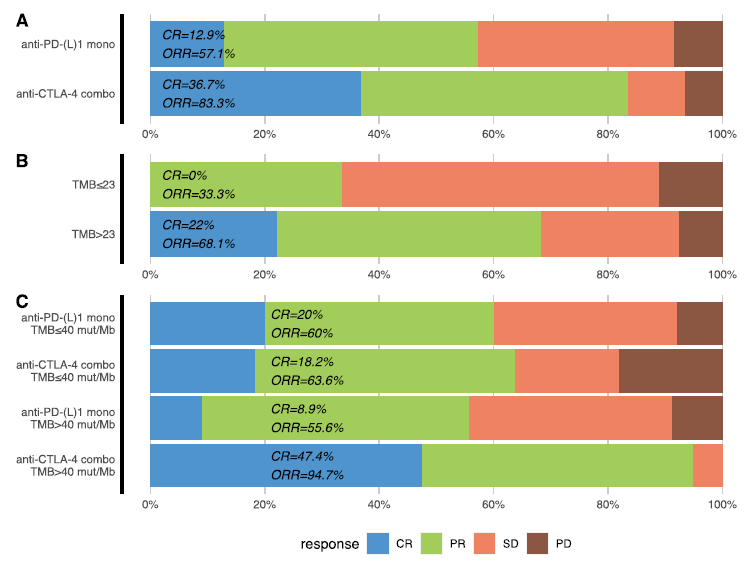
图4. 不同治疗类型(A)、预后TMB cut-off(B)及结合ICI治疗类型及预测TMB cut-off(C)的肿瘤缓解情况
讨论
本研究是针对接受ICI治疗的dMMR/MSI-H mCRC患者的回顾性研究,研究发现无论是抗PD-(L)1单抗单药治疗,还是联合抗CTLA4单抗的联合治疗,TMB相对较低的患者接受免疫治疗后的预后均极差,与接受抗PD-(L)1单药治疗相比,TMB相对较高的患者接受抗PD-(L)1和抗CTLA-4单抗联合治疗的患者获益最大。
FDA已经批准TMB-H可指导晚期实体瘤接受帕博利珠单抗治疗。此外,TMB可能作为多种肿瘤免疫治疗疗效预测的潜在生物标志物。但由于不同平台的TMB cut-off值及异质性等原因,限制了TMB在免疫治疗优势人群中的应用。dMMR/MSI-H (并非TMB)状态是经验证的免疫治疗疗效正向预测生物标志物,所有主要指南均推荐MSI状态可指导mCRC一线治疗选择。
值得注意的是,部分患者接受ICI治疗早期即会出现疾病进展,推测可能与免疫治疗原发耐药相关。某些临床因素与较高的疾病快速进展率相关,如较差的体能状态、较高的基线炎症指数、有腹水及在后线接受ICI治疗。
此外,目前在MSI-H CRC中,正在进行一些与免疫冷肿瘤表型相关的分子生物标志物研究。其中,TMB无疑是最具潜力的生物标志物。与本研究结果相一致, Shrock等人的研究结果发现针对接受抗PD-(L)1单抗单药治疗的dMMR/MSI-H mCRC,可区分预后的最佳TMB cut-off值为37-41 mut/Mb。TMB较低患者的预后较差,可能与以下因素相关:首先,由于新抗原表位数量不足,相对较低的TMB导致肿瘤免疫原性降低;此外,较低的TMB可能与dMMR/MSI-H肿瘤免疫编辑过程中的克隆性进化有关。
本研究表明TMB可用于筛选双免联合治疗的最大获益人群,例如在TMB> 40mut/Mb患者中接受抗PD-(L)1和抗CTLA-4单抗联合治疗与100%的无事件生存相关。相反,TMB中等水平患者在接受抗PD-(L)1单抗基础上,联合抗CTLA-4单抗则无类似结果,还可能产生不必要的毒副作用。目前已有两项研究(CheckMate 8HW和 KEYSTEP-008)正在进一步验证高TMB对于免疫单药和双免联合治疗的疗效预测价值。






