臻知识·专家访谈 | 第17期

近年来,免疫治疗为肿瘤患者带来了曙光,但探索更多可用于预测免疫治疗疗效的分子标志物,是更多肿瘤患者获益于免疫治疗的前提和基础。求臻医学特邀中国医科大学附属第一医院胃肠外科/疝外科周建平教授,结合近期发表在JCO® Precision Oncology杂志上的文章进行解读。
周建平教授:近年来,肿瘤免疫治疗取得了令人瞩目的成果,诸多临床研究均已证实免疫治疗可改善肿瘤患者的预后,显著延长患者生存期。同时,国内外多家PD-1单抗均已在国内上市,让肿瘤免疫治疗在国内得到了充分的普及。但临床实践中,并非所有患者都能从免疫治疗中获益,仅有 20-40% 的患者对于免疫治疗有应答,如何精准筛选免疫治疗潜在获益群体尤为重要。目前除了MSI-H和TMB-H,是否还有其它生物标志物可预测泛癌种免疫治疗疗效呢?
本研究回顾性分析MD Anderson癌症中心458名POLE突变患者的临床病理学特征、共突变模式和免疫治疗疗效的相关性,发现POLE致病性突变的发生比例为15%,并针对接受PD-1/L1单抗单药治疗或联合CTLA-4单抗的双免治疗的82例患者的数据进行分析,发现与POLE良性突变患者相比,致病性突变患者的临床获益率(CBR)更高(82.4% vs 30.0%,P = .013),mPFS(15.1 vs 2.2个月,P< .001)、mOS(29.5 vs 6.8个月,P< .001)和疗效维持时间更长(15.5 vs 2.5个月,P< .001)。PFS和OS数据经共突变数目(≥ 10 个vs < 10个)和MSI/MMR状态校正后,该结论依然成立。综上,POLE致病性突变或可成为免疫治疗的疗效预测生物标记物。
POLE突变可预测免疫治疗疗效,早在2019年JAMA Oncol发表的一篇文章中就有提到,但是并未对具体的突变类型进行细致分析。本研究是迄今为止首个针对POLE具体突变类型、共突变数目及MSI状态与免疫治疗治疗应答相关性进行分析的研究。该研究发现POLE致病性突变患者接受免疫治疗的疗效及生存期均优于良性POLE突变患者,而且这种预测作用独立于MSI状态和基因共突变数目。POLE致病性突变或可成为下一个泛癌种免疫治疗疗效预测标志物,这将有助于扩大免疫治疗获益人群。未来,我们也希望有更多的分子标志物可以用来预测免疫治疗疗效,基于这些特征基因突变建立分子标志物模型或可填补目前泛癌种生物标志物对于免疫治疗疗效预测的盲区,实现对免疫治疗获益人群的精准分组。
摘要
DNA聚合酶ε对DNA复制的校对和保真至关重要。POLE突变与肿瘤高度突变及免疫治疗疗效相关。本研究通过回顾性分析MD Anderson癌症中心458名POLE突变患者的临床病理学特征、共突变模式和疫治疗疗效,发现POLE致病性突变的发生比例为15%。针对接受PD-1/L1单抗单药治疗或联合CTLA-4单抗的双免治疗的82例患者的分析结果显示,与POLE良性突变患者相比,致病性突变患者的临床获益率(CBR)更高(82.4% vs 30.0%,P= .013),mPFS(15.1 vs 2.2个月,P< .001)、mOS(29.5 vs 6.8个月,P< .001)和疗效维持时间更长(15.5 vs 2.5个月,P< .001)。PFS和OS数据经共突变数目(≥ 10个 vs < 10个)和MSI/MMR状态校正后,该结论依然成立。综上,POLE致病性突变或可成为免疫治疗的疗效预测生物标记物。
研究背景
POLE基因可编码DNA聚合酶ε,具有3'-5' 核酸外切酶活性,是参与DNA校对及复制的关键酶。POLE体系及胚系突变引起的校对缺陷,尤其是268-471密码子的突变更容易发生MSI-H,并和超突变相关。虽然现在免疫治疗应用广泛,但关于免疫(ICI)治疗的最佳疗效预测标记物目前仍存在争议。既往针对泛癌种的一项研究显示,POLE突变及POLD1突变患者的OS显著延长(34 v 18 个月; P = .004),且可能从ICI治疗中获益。但这项研究并未剖析突变位置或是否是致病性突变对于治疗应答是否有影响。本研究旨在分析POLE突变晚期肿瘤患者的临床病理学特征,明确POLE致病性突变与ICI治疗预后的关联。这是迄今为止首次关于POLE致病性突变患者的大型研究。
研究方法
对MD Andersen癌症中心(MDACC)的POLE突变及共突变的晚期患者的NGS数据和临床数据进行回顾性分析。POLE突变状态可分为良性、可能良性、致病性及可能致病性突变。
研究结果
1. POLE致病性突变
研究初步纳入14229例晚期实体瘤患者的NGS数据,从中筛选出486例(3.4%)POLE突变患者。其中453例患者可追溯临床资料。POLE突变可分为:致病性突变(15%)、良性突变(15.9%)、未知意义变异(VUS)(69.1%)。68例患者突变发生在核酸外切酶区域:47.1%为致病性,8.8%为良性,50%为VUS(图1)。

图1. A:POLE基因突变分布状态;B:POLE核酸外切酶域突变结构图
2. 免疫治疗疗效
172/453例患者接受ICI治疗。对其中121例符合条件的晚期患者进行评估,64例接受ICI单药治疗,19例接受CTLA-4抑制剂联合治疗,39例接受化疗/靶向药/疫苗联合治疗(表1)。反应率数据见表2。致病性突变患者的CBR优于良性突变患者(81.0% vs 38%,P = .01),ORR亦如此(52.4% vs 11.1%, P = .014)。在仅接受ICI治疗(单药或联合CTLA-4抑制剂)的82例患者中,致病性突变的CBR优于良性突变患者(82.4% vs 30.0%,P = .013),其中8例携带POLE核酸外切酶域致病性突变患者的RR率为37.5%(图1B)。
表1. 接受ICI治疗的POLE突变患者的基线特征


表2. 接受ICI治疗患者的最佳疗效
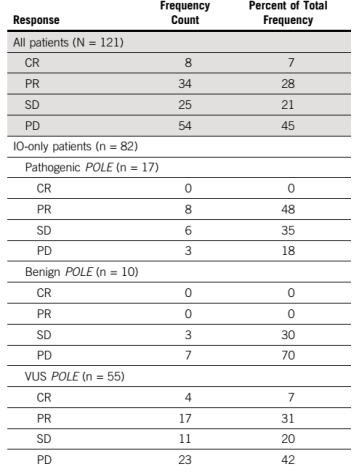
3. 生存分析
121例患者的mPFS为5.4月,12月PFS率为35%。致病性突变患者mPFS优于良性突变患者(15.1 vs 2.8个月,P<.001)。VUS患者mPFS为4.9月(图2A)。接受免疫治疗患者的mOS为29.5月,12月OS率为77%。POLE致病性突变的mOS显著优于良性突变患者(29.5 vs 11.6个月,P< .001)(图3A)。
4. 仅接受IO治疗患者的生存
82例仅接受IO治疗的患者中,致病、良性POLE突变患者mPFS分别为15.1月和2.2月,P< .001(图2B);通过共突变数目(≥ 10 个vs < 10个)和MSI/MMR状态进行校正,发现POLE致病性突变患者的PFS显著优于良性突变患者(HR, 0.07; P <.001)。mOS分别为29.5月和6.8月,P< .001(图3B),经共突变和MSI/MMR状态校正后,该结论依然成立。因此,与良性突变患者相比,致病性突变患者接受单药ICI或联合CTLA-4的疗效维持时间更长(15.5 vs 2.5个月,P< .001)。
5. POLE突变总人群的生存
453例患者总体mOS为6.8年。致病性突变患者OS显著优于良性患者:NR vs 3.4年,亦显著优于VUS患者:NR vs 8.0年(图3C)。

图2. ICI治疗患者的PFS

图3. ICI治疗患者的OS
与良性突变患者相比,致病性突变患者的共突变率更少、PD-L1阳性率和MSI-H率更高(表1)。共突变情况见图4A。致病性突变患者的共突变多存在于DDR通路(图4B、图4C)。

图4.A:POLE突变患者的共突变情况;致病性POLE突变患者更多与DDR基因呈共突变,如(B)热图及(C)柱状图所示
讨论
近期研究主要关注POLE突变与高突变表型肿瘤之间的关联,为免疫治疗提供有力依据。本研究首次强调POLE致病性突变的重要性。接受免疫治疗(单药或联合CTLA-4)的POLE致病性突变患者的CBR优于良性及VUS突变患者。且良性突变患者接受免疫治疗并无影像学应答。
POLE核酸外切酶结构域的突变与肿瘤的高突变状态、对免疫治疗的反应以及改善预后密切相关。接受免疫治疗的患者中,仅12.4%存在POLE核酸外切酶结构域突变。由于样本量有限,POLE致病性突变的位置,突变类型与免疫治疗应答之间的关系无法进行对比分析。
接受免疫治疗的POLE致病性突变患者的PFS(15.1 vs 2.2个月; P < .001)及OS(29.5 vs 6.8个月; P < .001)均较良性患者延长,且疗效持续时间显著延长(15.5 vs 2.5个月; P < .001)。经MSI状态及共突变数目校正后,PFS差异仍然存在。ICI治疗的所有患者中,34%应答患者共突变数目<10个。这提示POLE突变肿瘤可能存在更多免疫原性与ICI治疗应答相关,与共突变数目无关,以上研究结果为这一推论提供初步理论依据。在接受ICI单药治疗的患者中,共突变数目与疗效并不相关。并且,研究发现致病性突变肿瘤更易与DDR通路中的基因发生共突变,特定DDR共突变与ICI治疗获益相关。
由于样本量不足,无法更全面地评估POLE致病性突变在既往免疫耐药肿瘤中的作用。研究中79%患者基于肿瘤和分子亚型符合FDA批准的免疫治疗适应症,因此对于其余免疫耐药患者的耐药原因无法得出有意义结论。但无论是基于传统免疫分型还是超突变定义的免疫敏感或免疫耐药患者,POLE致病性患者均可从ICI治疗中获益。因此,更需对FDA获批适应症之外的、与POLE校正缺陷超突变相关肿瘤ICI疗效进行进一步的大样本分析。另外,68%入组人群为POLE VUS突变,其中38%对ICI单药治疗有应答。因此,需进一步对这些突变进行注释,阐明肿瘤内在免疫敏感性背景下不同VUS对于免疫敏感性差异性提示。






