臻知识·专家访谈 | 第24期

近年来,针对EGFR ex20ins的靶向治疗初见成效,但其临床诊治仍面临一些挑战。随着NGS在NSCLC临床精准诊疗中的应用,越来越多准确且可靠的分子标志物被发现并在临床实践中被验证,能否借助NGS等技术验证解决EGFR ex20ins不同治疗方式及疗效预测标志物值得关注。求臻医学特邀青岛大学附属医院邱文生教授,结合近期发表在European Journal of Cancer杂志上的文章进行解读。
邱文生教授:EGFR ex20ins是继19del,L858R突变之后,NSCLC精准治疗的又一热门靶点,在EGFR突变阳性NSCLC约占10%。近年来针对EGFR ex20ins的靶向治疗初见成效,莫博替尼(Mobocertinib)和埃万妥单抗(Amivantamab)已被FDA获批,波齐替尼、DZD9008和CLN-081也在进行临床试验。但针对于EGFR ex20ins的临床诊治仍面临一些挑战:一是临床研究并没有纳入接受标准治疗的对照组进行对比,二是EGFR ex20ins肿瘤具有较强的异质性,其共突变、插入变体及免疫微环境都会影响治疗效果。这些问题或可借助NGS等技术得以验证解决。
最新在European Journal of Cancer上发表的有关TP53共突变及免疫微环境对EGFR 20外显子插入肺癌不同治疗方式及疗效预测标志物进行了探索性分析。共纳入118例患者的临床治疗数据及分子特征进行回顾性分析,首先,发现铂类为基础的化疗(pCHT)及化疗联合免疫治疗(IOCHT)的疗效相当(ORR 20-25%,DCR≈80%, mPFS=7个月),优于TKI单药和单药化疗以及PD-(L)1抑制剂单药。脑转移以及 TP53突变阳性提示患者预后差,接受含铂双药化疗和EGFR TKI治疗后的PFS和OS均显著缩短(HR 3.3-6.1, p < 0.01);此外,虽然本研究中不同exon20ins突变位点患者的PFS及OS之间并无显著差异,但与PCR方法相比,NGS可额外检出30%-50%的EGFR ex20ins突变。最后本研究首次证实免疫特征在EGFR ex20ins突变患者预后预测中的价值(高CD8/Th1细胞比例,OS显著延长),其预测作用独立于TP53突变及脑转移。
总之,本研究表明EGFR ex20ins突变NSCLC患者更易从IOCHT和pCHT治疗中获益。脑转移、TP53突变阳性以及低CD8/Th1细胞比例是三个独立且提示预后差的因素。伴随着NGS在NSCLC临床精准诊疗中的应用,越来越多准确且可靠的分子标志物会被发现并在临床实践中被验证,为临床治疗策略制定提供有价值的参考,助力更加精准和个体化的治疗。
摘要
非小细胞肺癌(NSCLC)EGFR 20外显子插入突变(ex20ins)是靶向治疗的新兴靶点,但罕有报道关注传统治疗及分子特征对于治疗结局的影响。本研究通过回顾分析118例患者的临床治疗数据及分子特征,发现铂类为基础的化疗(pCHT)及化疗联合免疫治疗(IOCHT)的疗效相当(ORR 20-25%,DCR 80%,中位PFS≈7个月),优于单药化疗(ORR 9%, DCR 59%, mPFS 4.1 个月,p < 0.05)、EGFR-TKI(ORR 0%,DCR 46%,mPFS 3个月,p < 0.001)及单药PD-(L)1抑制剂(ORR 0%, DCR 30%,mPFS 2.1 个月,p < 0.001)。TP53共突变和脑转移患者接受含铂双药化疗和EGFR TKI治疗后的PFS和OS均显著缩短(HR 3.3-6.1, p < 0.01),肿瘤CD8+细胞增多及Th1细胞减少与OS延长显著相关,作为独立于脑转移和TP53突变状态的预后标志物(p < 0.01)。EGFR ex20ins“近环”和“远环”变异均有偶发案例持续应答超过1年。
研究背景
EGFR突变NSCLC患者中,EGFR ex20ins患者约占10%,对传统EGFR TKI耐药。尽管近期针对ex20ins的药物莫博替尼(Mobocertinib)和埃万妥单抗(Amivantamab)已被加速获批,波齐替尼、DZD9008和CLN-081也在进行早期试验。与此同时带来两个值得思考的问题,一是早期临床研究并没有纳入接受标准治疗的对照组进行对比,二是EGFR ex20ins肿瘤具有较强的异质性,其共突变、插入变体及免疫微环境都会影响治疗效果。本文意在探寻EGFR ex20ins临床疗效与分子标志物之间的关联,为EGFR ex20ins突变的非小细胞肺癌的标准治疗提供准确的疗效评估,并系统地确定患者预后的临床和分子决定因素。
研究方法
研究回顾性分析德国13家中心的EGFR ex20ins突变的NSCLC患者的临床数据。并收集患者的EGFR全部外显子及TP53 4-10外显子的突变数据。对于诊断时可提供组织样本的病例进行40基因panel的测序和RNA测序,用于突变信息和免疫微环境分析。
研究结果
入组人群
研究共入组118例患者(图1)。其中,113例患者未接受任何单独针对ex20ins的药物治疗,其中78例死亡,分析了总体的治疗类型和不同治疗线数之间的时间间隔。
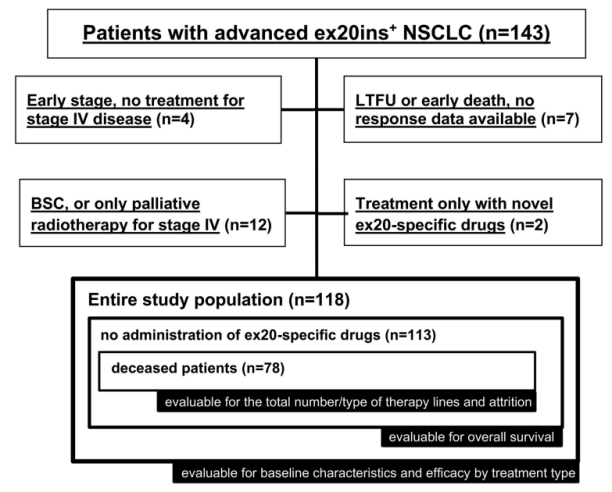
图1. 患者筛选流程
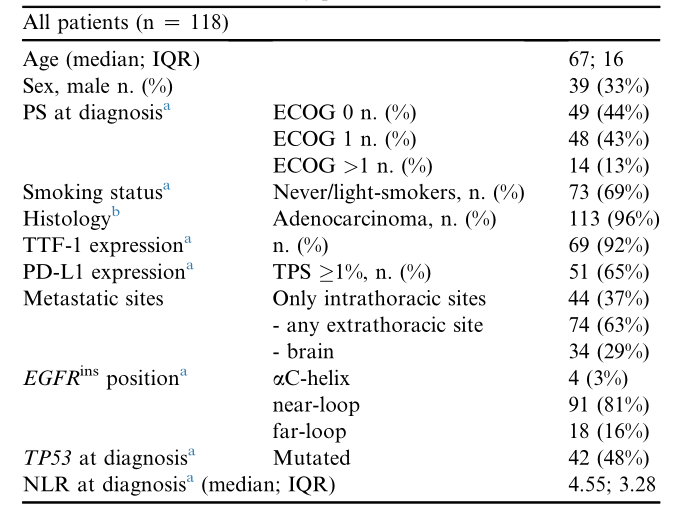
患者基线特征详见表1。经NGS分型的肿瘤中,ex20ins变异主要集中于“近环”(A767-P772,81%),其次为“远环”(H773-C775,16%),以及“螺旋”(D761-M766,3%),未发现A763insFQEA。约半数(48%)病例携带致病性的TP53基因共突变,分布于4-9号外显子。
表1. 患者基线特征
系统治疗疗效及生存结局
铂类为基础的化疗(pCHT)及化疗联合免疫治疗(IOCHT)的疗效相似(ORR 23-24%,DCR 80%,中位PFS 6.5-7.8个月),优于单药化疗(ORR 9%, DCR 59%, mPFS 4.1 个月,p < 0.05)、EGFR TKI(ORR 0%, DCR 46%,mPFS 3个月,p < 0.001)及单药PD-(L)1抑制剂(ORR 0%, DCR 30%, mPFS 2.1 个月,p < 0.001)(表2、图2A、图2B)。EGFR TKI药物中,虽然奥希替尼的DCR和mPFS更长,但是没有统计学差异。
表2. 系统治疗疗效及患者生存
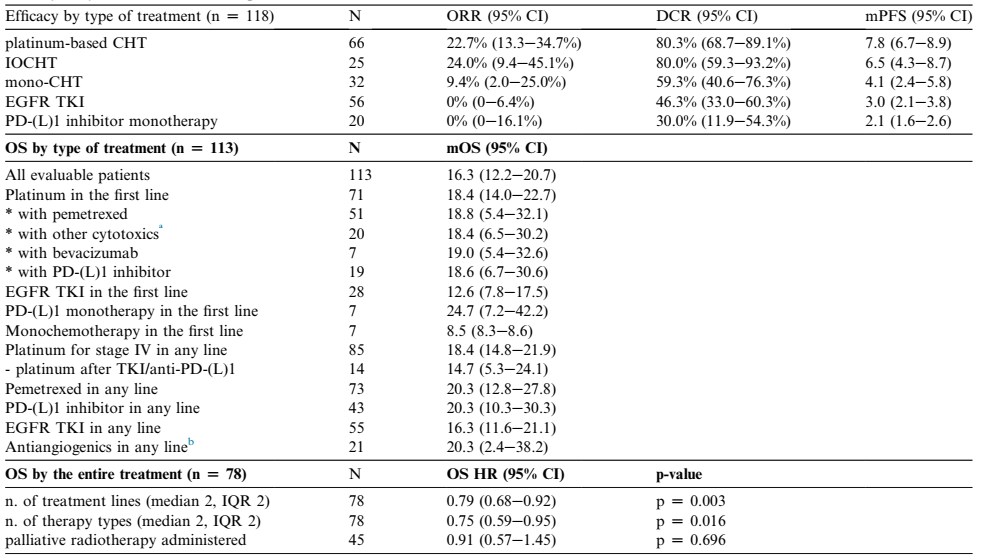
OS方面,中位OS为16.3个月,与是否一线行铂类化疗,或序贯于TKI/PD-(L)1抑制剂单药治疗之后没有统计学差异(表2,图2C)。同样,一线治疗或序贯治疗类型与OS不相关(图2D)。
多数患者接受至少两线系统治疗(55%),75%患者接受pCHT或IOCHT,49%患者接受EGFR-TKI,38%患者接受PD-(L)1抑制剂(图2E、表2)。分别有34%、38%及50%患者未能进入一/二/后线治疗(图2E)。死亡患者(78例)中,接受更多线数治疗方案的患者OS显著延长(HR 0.79, p =0.003)(表2),接受3-4种不同类型系统治疗患者的OS亦有显著延长( HR 0.75, p Z 0.016)(图2F、表2)。相比而言,姑息放疗与OS获益无相关性(表2)。
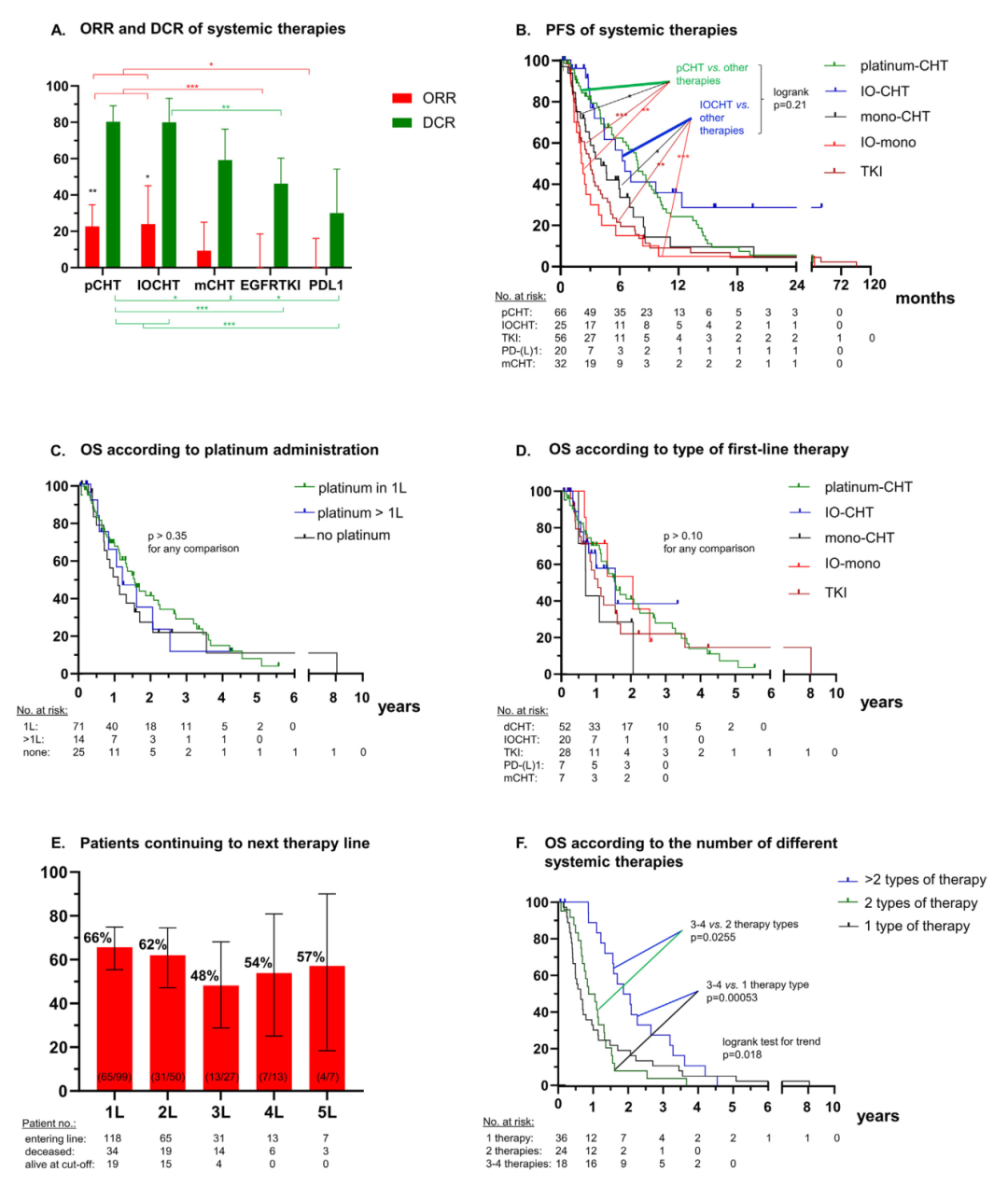
图2. EGFR ex20ins突变患者系统治疗疗效。A. ORR、DCR;B. PFS;C.铂类化疗的OS;D.一线治疗的OS;E.进入下一线治疗的患者比例;F.不同系统治疗线数的OS
与不同治疗方式预后相关的肿瘤特征
通过分析不同治疗方式与生存获益之间的相关性,发现仅在EGFR TKI治疗中的治疗线数对生存产生显著影响,若在化疗之后给药,则疗效降低。但若铂类为基础的化疗序贯于TKI治疗,其疗效无明显变化。有脑部等胸外转移的患者OS显著缩短(HR 3.7-6.4, p < 0.0001),接受pCHT治疗和TKI治疗的PFS也显著缩短(pCHT:HR 3.2-6.1,p < 0.0001;TKI: HR 2.4-3.3, p < 0.01)。经pCHT及TKI治疗的TP53共突变患者的PFS显著缩短(HR 2.1-2.5, p < 0.05)(图3A、图3B),并且此类患者的OS显著缩短(mOS: 12.6 vs 39.4个月,p = 0.0043)(图3C)。不同exon20ins突变位点患者的PFS及OS之间并无显著差异(图3D)。
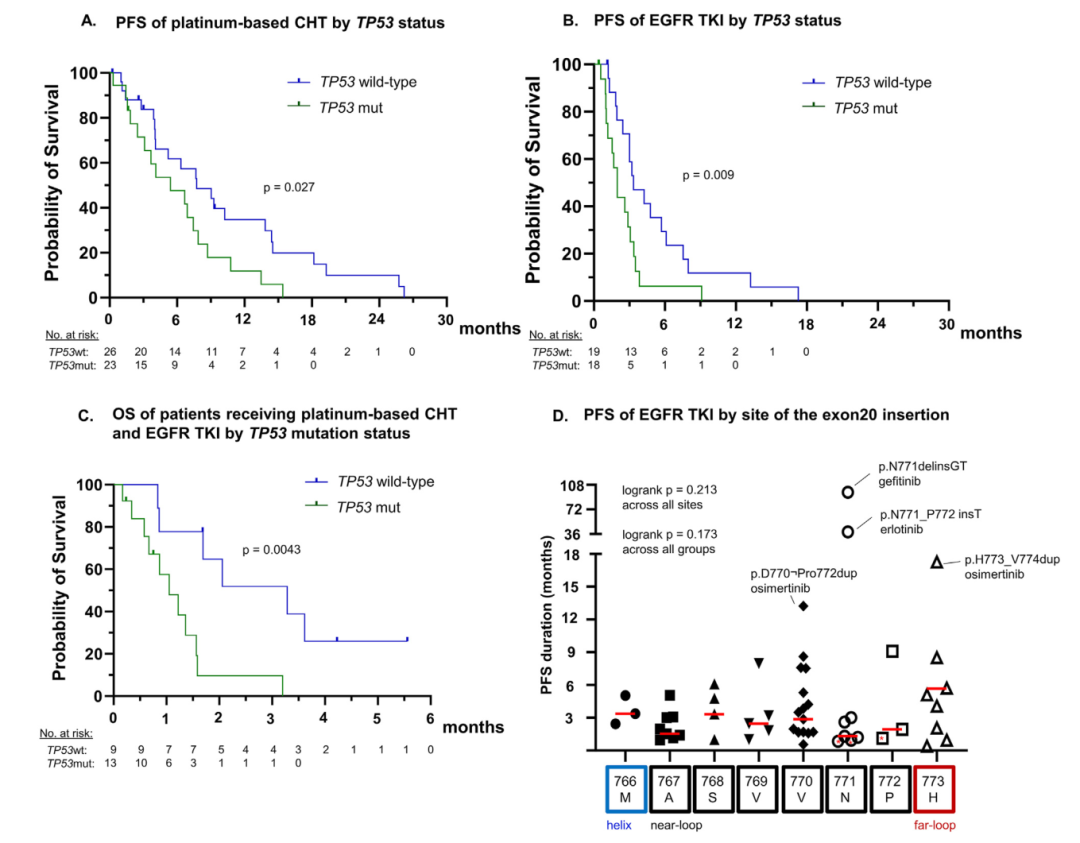
图3. EGFR ex20ins突变患者TP53或EGFR变体与生存的关联。A. 不同TP53状态患者应用铂类化疗的PFS;B. 不同TP53状态患者应用EGFR TKI的PFS;C. 不同TP53状态患者应用铂类化疗及EGFR TKI的OS;D.不同20外显子插入部位患者应用EGFR TKI的PFS。
对12种免疫细胞群进行Nanostring测序,结果显示肿瘤微环境中CD8+T细胞比例增加、Th1 CDA+T细胞比例减少与OS延长呈显著相关(图4A)。OS延长患者中,CD8/Th1细胞比例显著升高,但不受脑转移及TP53突变影响,提示免疫因素对于OS的预测是一个独立的生物标志物(图4B)。与经典EGFR突变、ALK融合、ERBB2突变或野生型患者相比,OS延长的exon20ins 患者其CD8/Th1细胞更高(图4C)。经免疫治疗后长期缓解与快速进展的野生型患者之间的CD8/Th1细胞比例并无差异(图4C)。与野生型患者及EGFR经典突变患者相比, ex20ins突变患者的最显著差异在于Th1细胞显著减少。
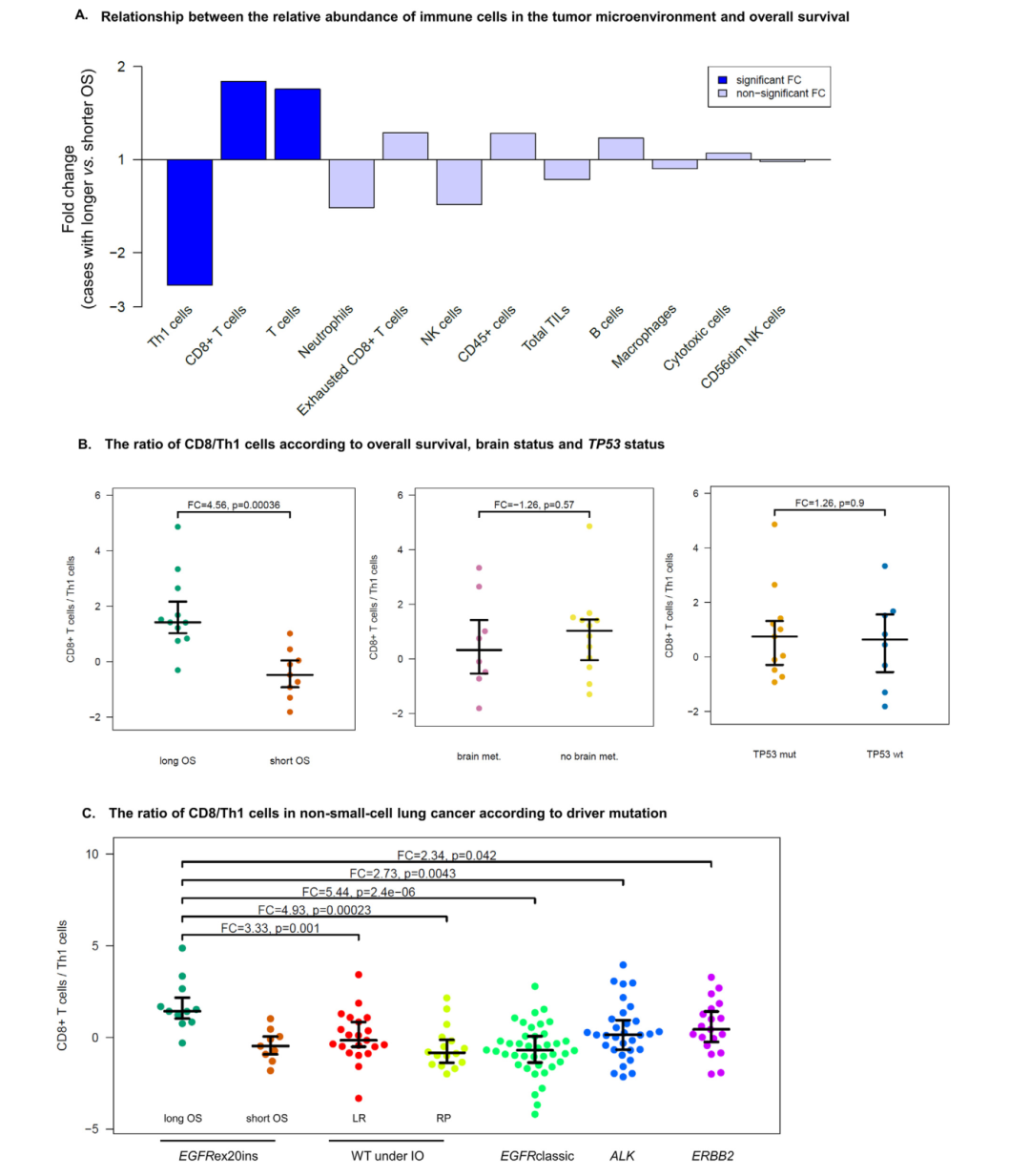
图4. EGFR ex20ins突变患者肿瘤免疫微环境参数与生存的关联。A. 肿瘤微环境免疫细胞丰度与OS的相关性;B. 不同OS、脑转移状态及TP53状态患者的CD8/Th1细胞比例;C.NSCLC不同驱动基因患者的CD8/Th1细胞比例。
讨论
本研究旨在为EGFR ex20ins突变NSCLC患者提供标准治疗的疗效评估。与EGFR TKI相比,铂类为基础的化疗PFS更长,PD-(L)1抑制剂单药有效性极低,与既往研究结论一致。但关于IOCHT的研究比较少且大多数研究结论存在争议,本研究提示IOCHT疗效接近于pCHT(ORR 20-25%,DCR≈80%, mPFS= 7个月),与PD-(L)1抑制剂疗效不佳相一致。但显著低于IOCHT用于ERRB2 ex20ins突变患者的疗效(ORR 52%),其PD-(L)1抑制剂单药的敏感性也较高(ORR 16%),提示ERRB2 与EGFR ex20ins突变有不同的免疫微环境。新药(moboceritinib、amivantamab)的疗效优于铂类化疗(ORR 35-40% VS 20-25%),但中位PFS相当,7-8个月左右。
研究发现多个临床及分子特征均可影响系统治疗的疗效。TP53突变对于EGFR ex20ins突变患者是一个预后不好的因素,导致pCHT及TKI治疗后生存期缩短,这可能与基因组不稳定相关。与PCR方法相比,NGS可额外检出30-50%的EGFR ex20ins突变。
Ex20ins变异的异质性与插入部位及TKI疗效不相关。在“近环”与“远环”亚组中发现大量变异形式及偶发的TKI持久疗效,甚至有些是同样接受一代TKI治疗的位于同一位点的变异。因此,根据突变位置进行突变分类的临床价值有限。
此外,本研究首次证实免疫特征(尤其是高CD8/Th1细胞比例)在EGFR ex20ins突变患者预后预测中的价值,其作用独立于TP53突变及脑转移。肿瘤微环境中CD8+/CD4+细胞比例升高已被证实是早期NSCLC术后的有利预后因素。肿瘤及血液中Th1细胞与NSCLC预后不良的关联,可能与IFN-γ介导的促肿瘤炎症反应及刺激髓系抑制细胞有关。Th1细胞在ex20ins突变患者中显著减少,CD8/Th1比例升高,提示强烈的免疫反应。但疗效欠佳,未来药物开发需要靶向PD-(L)1轴之外的免疫相关信号通路。
尽管不同治疗方案的疗效之间存在显著差异,本研究并未发现OS与一线用药类型相关,但OS与治疗线数及不同治疗类型总数相关。






