
近年来,伴随肿瘤靶向、免疫、核素治疗的发展,泌尿肿瘤领域取得长足进步。特别是以基因检测为代表的精准医学在泌尿肿瘤中的广泛应用,正在快速改变泌尿肿瘤领域诊疗模式。求臻医学聚焦重磅研究,紧追前沿热点,对泌尿肿瘤领域前沿进展进行梳理,特推出“探泌臻知”系列栏目。上期我们了解到免疫治疗标志物在前列腺癌中的应用和探索,本期,我们将为大家介绍177Lu-PSMA-617在前列腺癌中的研究进展,快跟随求小臻一起学习吧~
什么是PSMA
为什么它在前列腺癌中很重要?
前列腺特异性膜抗原(Prostate Specific Membrane Antigen, PSMA),一种II型跨膜糖蛋白,在大多数前列腺癌细胞表面过表达,在正常组织中表达量很少。其表达量与前列腺癌格林森(Gleason)分级相关,Gleason评分越高的前列腺癌PSMA表达量越高[1]。基于这种组织器官表达特异性,PSMA成为前列腺癌可靠的分子标记物,是前列腺癌诊断和治疗的理想靶点之一。
177Lu-PSMA-617
镥177(Lutetium-177)是一种放射性物质,会发出破坏性β射线,半衰期为6.7天。该物质通过与一个小肽结合形成复合物与前列腺癌细胞上的PSMA靶向结合,释放出高能β粒子,导致前列腺癌细胞及微环境DNA损伤。由于释放的高能β粒子穿透力较弱,177Lu-PSMA-617对周围的正常细胞影响较小,再结合其复合物的靶向引导作用,可达到精准杀伤肿瘤的目的[2]。

图1. 177Lu-PSMA-617模式图
Pluvicto(177Lu-PSMA-617)
FDA获批
去势抵抗性前列腺癌(Castration-Resistant Prostate Cancer,CRPC)阶段的治疗一直是前列腺癌治疗难点,患者生存时间较短一般在两年左右。转移性去势抵抗性前列腺癌(Metastatic Castration-Resistant Prostate Cancer,mCRPC)是前列腺癌疾病发展的终末阶段,目前对这类患者治疗方案不多,5年生存率较低。2022年3月23日,FDA批准Pluvicto(177Lu-PSMA-617)用于PSMA表达阳性且已接受过雄激素受体(AR)抑制剂和紫杉类治疗的mCRPC患者,是FDA批准的首款用于治疗mCRPC患者的靶向核素药物。
图2. Pluvicto(177Lu-PSMA-617)FDA获批情况
此次Pluvicto的获批是基于VISION试验关键性III期临床结果,该研究旨在评估177Lu-PSMA-617联合标准治疗(Standard of Care,SoC)在既往接受过至少一种雄激素受体抑制剂和一到两种紫杉类方案治疗且PSMA表达阳性的mCRPC患者中的疗效[3]。关键入组标准为:≥1处88Ga摄取量大于肝脏的PSMA阳性病灶;无骨骼PSMA阴性及软组织≥1cm、淋巴结≥2.5cm、实体器官≥1cm的阴性病灶。患者按2:1的比例随机分组,接受177Lu-PSMA-617+SoC或SoC。主要临床终点为影像学无进展生存期(rPFS)和总生存期(OS)。共有831例前列腺癌患者入组,中位随访时间为20.9个月。与SoC组相比,177Lu-PSMA-617+SoC组rPFS(中位rPFS,8.7个月 VS 3.4个月;HR 0.40;P<0.001)和总生存期显著延长(中位OS,15.3个月 VS 11.3个月;HR 0.62;P<0.001)。177Lu-PSMA-617组3级或以上不良事件的发生率高于对照组(52.7% VS 38.0%),但生活质量没有受到影响。今年ASCO大会公布了VISION试验探索性亚组分析结果,Lu-PSMA-617的rPFS和OS获益和先前其他亚组的结果一致。
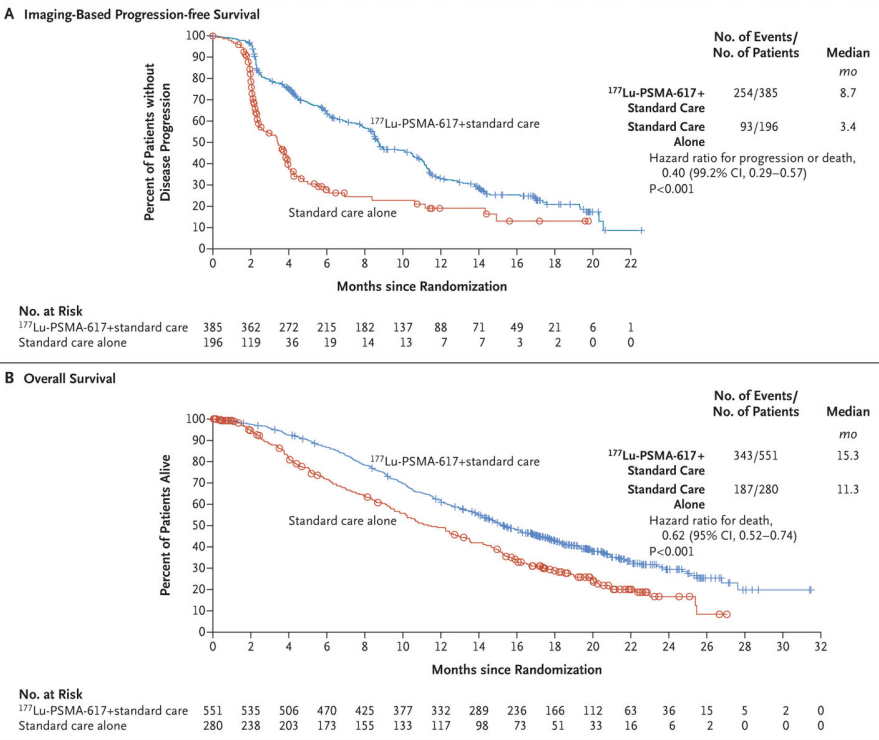
图3. VISION研究基于影像学的无进展生存期和总生存期
177Lu-PSMA-617
核素治疗阶段前移的相关探索
目前177Lu-PSMA-617研发布局进展迅速,另外几项重磅临床试验已启动,用于在更早治疗阶段探索177Lu-PSMA-617疗效。
Hofman等人报道的II期TheraP试验(NCT03392428;ANZUP 1603)是一项在新型内分泌治疗耐药且PSMA表达阳性mCRPC患者中评估177Lu-PSMA-617 与卡巴他赛疗效及安全性的随机、多中心、非盲研究。关键入组标准为:一个疾病部位的最大标准化摄取值(SUVmax)至少为20,所有其他可测量的转移性疾病部位的SUVmax>10且无FDG+/PSMA-病灶。患者按1:1随机分为两组:177Lu-PSMA-617组(99例,每6周静脉注射6.0–8.5 GBq,最多6个周期)或卡巴他赛组(101例,每3周静脉注射20 mg/m²,最多10个周期)。主要研究终点是PSA50应答率,次要研究终点包括OS、PFS、PSA-PFS等。
与卡巴他赛组相比,177Lu-PSMA-617显著提高PSA50应答率:65/99 vs 37/101;95% CI 16-42; p<0.0001,且有更低的3-4级不良事件(33% vs 53%)[4]。今年ASCO大会进一步更新了TheraP 3年OS随访结果,与卡巴他赛相比,177Lu-PSMA-617不良事件更少, LuPSMA 与卡巴他赛的总生存期相似(HR 0.97,95% CI 0.7-1.4,P=0.09)。

图4. 177Lu-PSMA-617 PSA50应答率
此外,PSMAfore(NCT04689828)正在评估177Lu-PSMA-617对比雄激素受体抑制剂治疗(Androgen receptor-directed therapy,ARDT)序贯治疗,对ARDT治疗进展且未接受化疗的mCRPC患者的影响。PSMAddition(NCT04720157)正在研究177Lu-PSMA-617加SoC(ADT+ARDT)与单纯SoC治疗在转移性激素敏感性前列腺癌(Metastatic Hormone-Sensitive Prostate Cancer,mHSPC)患者的影响。
这两项研究的主要终点是影像学无进展生存期。更多的临床研究正在进行中,如Azad和 Hofman等人正在进行的UpFrontPSMA (NCT04343885)随机II期临床研究,用于评估177Lu PSMA-617 +ADT +多西他赛vs ADT+多西他赛在初诊转移性前列腺癌患者中的疗效。LuTectomy (NCT04430192)是一项1/2期临床研究,用于评估177Lu-PSMA-617在接受根治性前列腺切除术和盆腔淋巴结清扫的局部或局部高危晚期前列腺癌患者新辅助治疗的疗效[5,8]。已经陆陆续续有一些可观的研究数据,177Lu-PSMA-617核素治疗的前移可能能为前列腺癌患者带来更多的益处。
核素治疗与其他通路药物联合
在前列腺癌中的治疗效果值得期待
核素治疗可以杀死癌细胞,诱导新抗原表达,同时触发促炎介质的释放,重塑肿瘤免疫微环境,增强肿瘤浸润性免疫细胞活性,将“冷肿瘤”变成“热肿瘤”,加强免疫治疗的效果。此外,还会导致肿瘤细胞DNA出现大量双链和单链断裂,诱导DNA损伤,通过与PARP抑制剂联合使用达到“合成致死”的效应[9]。
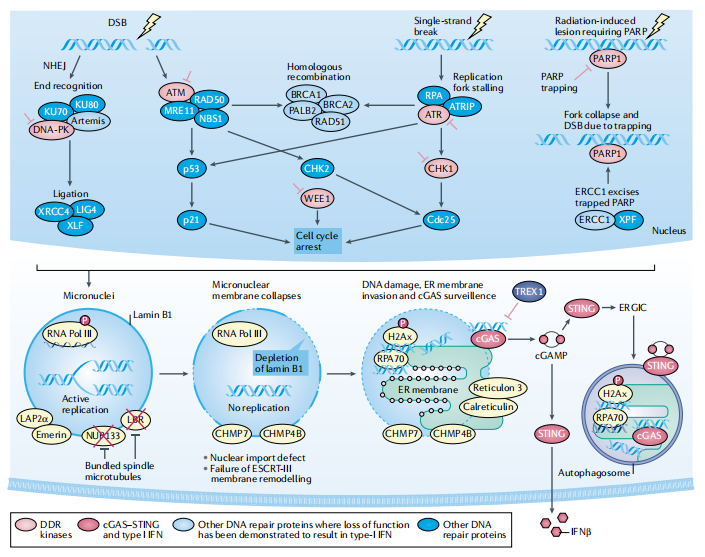
图5. 放疗诱发微核形成及DNA损伤反应
目前已有一些PSMA核素治疗与PARP抑制剂/免疫检查点抑制剂联合使用的小型临床研究在进行,如I期NCT03874884(LuPARP)剂量递增和剂量扩展试验[10],旨在评估奥拉帕利+ 177Lu-PSMA-617方案的安全性和耐受性;目前正在招募中,要求入组患者新型内分泌治疗进展,且未接受过铂类、PARP抑制剂或177Lu-PSMA-617治疗。
另一项Ib期临床研究(NCT03805594)已完成入组,用于评估177Lu-PSMA-617联合帕博利珠单抗在mCRPC患者中的用药剂量、用药时间及客观反应率[11];鉴于核素治疗与免疫治疗、PARP抑制剂靶向治疗协同作用机制,这两项联合治疗的临床结果值得期待!
表1. 177Lu-PSMA-617临床研究汇总

小结与展望
随着研究的深入以及药物的上市,我们可以看到以PSMA为靶点的核素治疗已步入快车道。177Lu-PSMA-617作为以PSMA为靶点的放射性配体疗法的代表性药物以其独特的性能和出色的临床结果成为PSMA核素治疗研究热点,从mCRPC到mHSPC,从单药治疗到与PARP抑制剂及免疫检查点抑制剂联合治疗,其研发布局进展迅速。相信在不远的将来,PSMA这一靶点可以更好的应用于临床,177Lu-PSMA-617可为更多的前列腺癌患者带来更大的福音!
求臻医学
泌尿系列肿瘤基因检测方案
求臻医学从临床诊疗痛点出发,与泌外科顶级专家团队开展深度合作,结合最新研究进展深度打磨泌尿系列专属产品,全面覆盖前列腺癌、膀胱癌、肾癌等泌尿肿瘤多个治疗阶段,满足临床不同需求;同时针对患者疾病诊疗史进行个体化精准解读,辅助临床治疗决策;作为《中国肿瘤基因图谱计划》(CGAC)项目的转化成果,该系列产品定制化设计了国内外泌尿肿瘤高频突变基因panel,紧跟泌尿前沿贴近中国临床实践;通过指导肿瘤精准用药、疗效监控及健康管理提供全面有效的参考信息,为泌尿肿瘤患者保驾护航!






