
近年来,伴随肿瘤靶向、免疫、核素治疗的发展,泌尿肿瘤领域取得长足进步。特别是以基因检测为代表的精准医学在泌尿肿瘤中的广泛应用,正在快速改变泌尿肿瘤领域诊疗模式。求臻医学聚焦重磅研究,紧追前沿热点,对泌尿肿瘤领域前沿进展进行梳理,特推出探泌臻知”系列栏目。本期,我们将着重介绍尿路上皮癌MRD监测及相关研究进展,快跟随求小臻一起学习吧~
尿路上皮癌(Urothelial Carcinoma,UC)是一种常见的泌尿系统恶性肿瘤,包括膀胱癌、肾盂癌、输尿管癌以及尿道癌,其中膀胱癌最常见。据世界卫生组织估计,2020年全球新增膀胱癌病例57.3万,死亡病例21.3万,并有不断增加的趋势[1]。对于肌层浸润性膀胱癌(Muscle-Invasive Bladder Cancer,MIBC),根治性膀胱切除术为治疗首选。但20%的淋巴结阴性患者和80%的淋巴结阳性患者根治术后会出现复发转移[2]。主要原因是当肿瘤被切除时,可能存在一些难以观测到的残留肿瘤成分,被称为分子残留病灶(Molecular Residual Disease,MRD)。一旦出现转移,尿路上皮癌将进入疾病终末期,预后不佳,5年生存率约5%[3]。
然而,目前在膀胱癌等尿路上皮癌中监测复发和治疗疗效的手段有限,主要以CT影像学为主,其监测潜力受到检测限和检测次数等方面的限制。尤其是膀胱切除术后早期转移性的微小病灶,无法通过影像学进行检测。因此,转移性复发和/或进展的早期检测以及治疗效果的评估是尿路上皮癌面临的主要临床挑战。
MRD预测膀胱癌术后的预后
残留的肿瘤病灶或早期转移复发的肿瘤细胞坏死、凋亡后会在血液中释放循环肿瘤DNA(ctDNA)。近年来,基于ctDNA状态的MRD评估已作为诊断疾病分期、评估肿瘤负荷、监测早期复发和评估治疗疗效的生物标志物,应用于多种肿瘤[4-5]。一项膀胱癌的临床研究纳入了68名局部进展期MIBC患者,连续动态采集了656份外周血,进行了ctDNA状态监测,以评估与预后的相关性[6]。
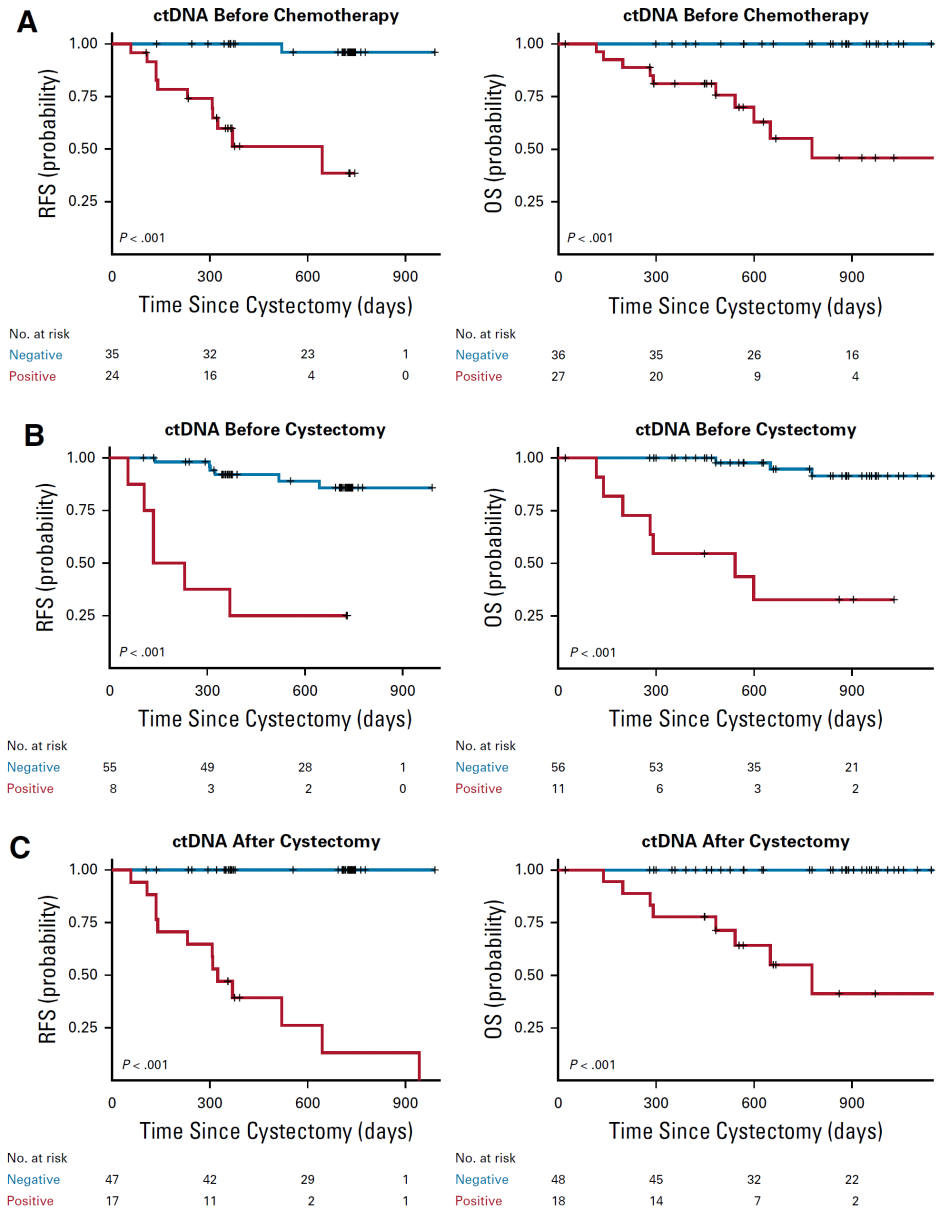
图1. 基于ctDNA的MRD检测的预后价值
该研究对膀胱尿路上皮癌的3个时间节点的ctDNA状态进行了分析。化疗前诊断时(时间点1,图1A)的ctDNA阳性(即MRD阳性,下同)患者,术后的总复发率和12个月复发率分别为46%(11/24)和42%(10/24)。值得注意的是,在第一个时间点ctDNA阴性(即MRD阴性,下同)的患者中,只有3%(1/35)在研究期间出现了复发(P<0.001;12个月,0% [0/35;P<0.001])。由于微转移扩散的风险低,ctDNA阴性的患者可能从术后辅助化疗中的获益较低。因此,在这个早期时间点检测到ctDNA是化疗和膀胱切除术后长期临床结局的一个强有力的预后因素。
化疗后和膀胱切除术前(时间点2,图1B)的ctDNA阳性患者中,术后总复发率和12个月复发率均为75%(6/8)。在ctDNA阴性患者中,总复发率和12个月复发率分别为11%(6/55;P<0.001)和7%(4/55;P<0.001)。
第三个时间节点是膀胱切除术后(图1C)。此时,ctDNA阳性患者的总体复发率和12个月复发率分别为76%(13/17)和59%(10/17)。在ctDNA阴性患者中,两个时间点的复发率均为0%(0/47;P<0.001)。膀胱切除术后任何时间点的ctDNA状态都强于任何其他预测因素。此外,在多变量Cox比例风险回归分析中,ctDNA状态是膀胱切除术后无复发生存的最强预测因子(HR,129.6;P<0.001)。
43%的患者(27/63)在化疗前或化疗期间检测,到了ctDNA。对于在治疗期间ctDNA清除的患者,其中有53%的患者出现病理性降期;而对于ctDNA未清除的患者,没有发现降期。值得注意的是,对于化疗前或化疗期间ctDNA阳性的患者,化疗期间ctDNA动态监测的结果与患者预后的相关性优于病理分期。该研究建议在化疗期间对ctDNA阳性患者进行持续的ctDNA状态监测,以评估治疗效果。
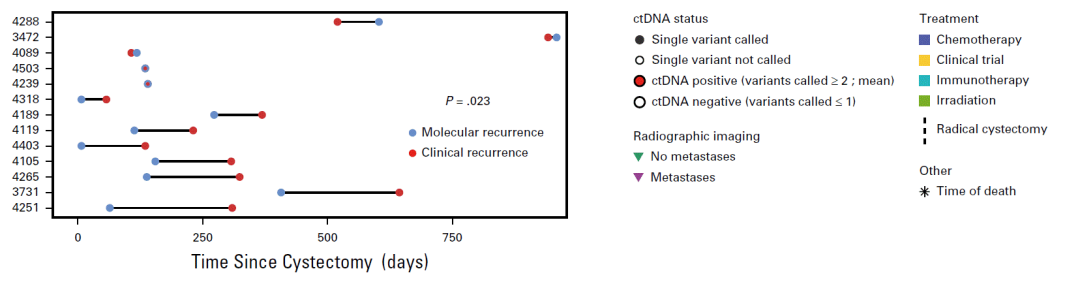
图2. 分子复发(ctDNA阳性)较临床复发(影像阳性)的时间更为提前
膀胱切除术后的ctDNA状态可作为隐匿性癌细胞和残留疾病的直接证据,ctDNA状态是根治性术后患者预后和早期复发风险预测的强力生物标志物。与影像学相比,基于ctDNA状态的复发监测可提前245天(中位数为96天)预测复发(图2)。这为提早治疗提供绝佳的机会,同时也可能提高治疗效果,从而提高生存率。因此,治疗期间的ctDNA状态同样也是化疗获益和患者预后的预测因子。
IMvigor010:柳暗花明又一村
基于MRD识别患者的个性化治疗或提前进行疾病干预,而不是治疗未经选择的患者或等待复发,将是未来癌症治疗的一个重要里程碑。
和其它肿瘤相比,尿路上皮癌和免疫治疗相识甚早,是最早被证实具有“免疫原性”的肿瘤之一。IMvigor010(NCT02450331)是一项全球多中心开放标签随机Ⅲ期临床试验,旨在评估阿替利珠单抗(Atezolizumab)在肌层浸润性尿路上皮癌(MIUC)辅助治疗中的作用。遗憾的是,阿替利珠单抗在IMvigor010研究的无病生存期(DFS)和总生存期(OS)没有显示出显著的获益,试验未能达到研究终点[7]。但庆幸的是,该研究在基于MRD预测免疫疗法的治疗结果方面无心插柳,取得了意料之外的研究成果,于2021年发表于《Nature》,题为“ctDNA guiding adjuvant immunotherapy in urothelial carcinoma”[8]。
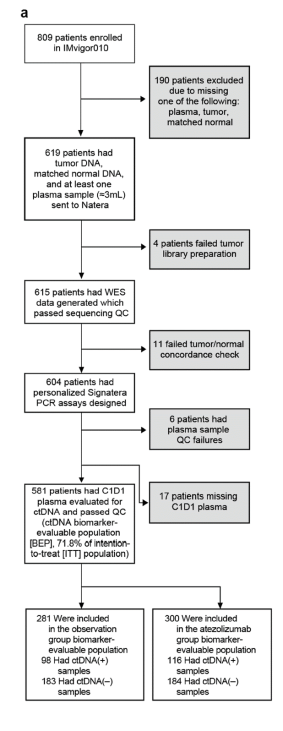
图3. IMvigor010 ctDNA生物标志物可评估人群(BEP)纳入标准
结果显示(图4),术后C1D1时间节点的ctDNA呈阳性的患者比阴性患者有更高的癌症复发风险。术后ctDNA阳性患者(37%,214人)在接受阿替利珠单抗辅助治疗后预后有所改善。相较于观察组,阿替利珠单抗组的无病生存(DFS)率提高了42%(5.9个月vs 4.4个月,HR=0.58),总生存(OS)率提高了41%(25.8个月 vs 15.8个月,HR=0.59)。至C3D1时间点,甚至有18.2%的患者获得了ctDNA清除,高于观察组(3.8%)(P = 0.0204)。而术后ctDNA阴性患者(63%)接受阿替利珠单抗治疗后,DFS和OS并没有明显变化,未得到治疗获益。
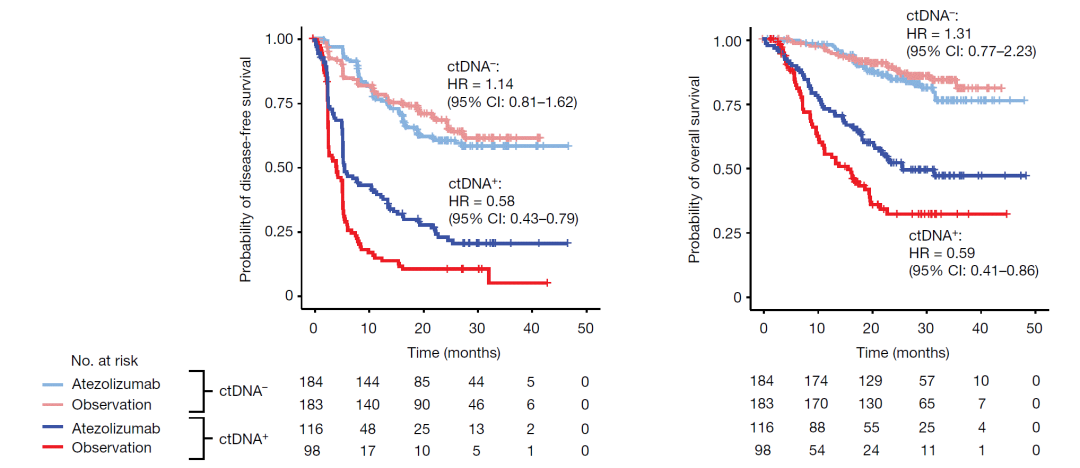
图4. ctDNA状态评估术后患者的预后
MRD面临的技术挑战及展望
毋庸置疑,基于ctDNA的MRD评估是尿路上皮癌预后评估极具前景的分析策略。基于检测结果,ctDNA持续阴性的膀胱癌患者具有更低的复发风险,对于术后辅助免疫治疗的获益较低;ctDNA阳性的患者可从术后免疫治疗中获益;基于ctDNA状态评估可比影像学更早地预测复发。与此同时,MRD的临床广泛应用仍然面临诸多挑战,包括根治性术后ctDNA水平较低,突变较为个性化,需要极高测序深度以及进而产生背景噪音高和应用成本高等难题(图5)。
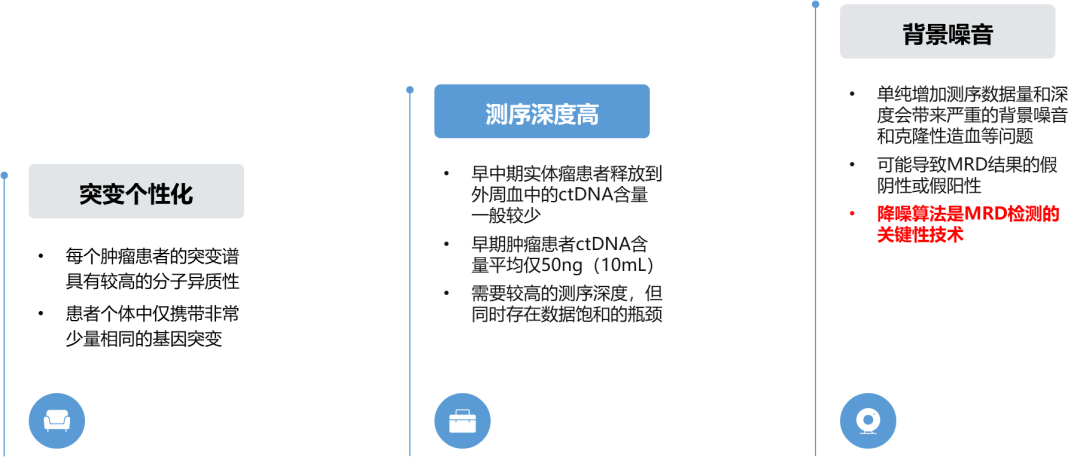
图5. MRD检测技术难点
MRD状态是一个前瞻性、探索性的生物标志物,其在尿路上皮癌术后的预后价值以及临床干预还需要进一步的研究来验证。相信在不久的将来,这些研究结果将会改变临床对包括尿路上皮癌在内的许多肿瘤的术后全程管理策略,极大地改善患者预后。
求臻医学
ChosenPace™MRD动态监测方案
求臻医学自主研发,倾力打造的ChosenPace™MRD动态监测方案,基于患者肿瘤组织检测1123个肿瘤相关基因突变情况(基线),通过UMI&神经网络机器学习三重降噪模型和万人大数据背噪库,有效过滤克隆性造血,降低系统噪音,在术后/其他根治性治疗后多次追踪患者ctDNA的个性化变异图谱,实现MRD的动态监测。ChosenPace™MRD的基线组织样本,在检测DNA水平的靶向药物的同时,还涵盖了常见融合基因的RNA表达情况,综合评估TMB、MSI、HLA分型等免疫治疗标志物及上百个免疫治疗正负向基因,提供全面准确的个体化诊疗信息,构建了肿瘤“筛、诊、治、监、预后”的完美闭环。






