臻知识·专家访谈 | 第26期

靶向治疗作为晚期NSCLC患者治疗的“三驾马车”之一,在NSCLC治疗中占据极其重要的地位。但如何能有效且及时评估靶向治疗的疗效,这也是目前临床在使用靶向治疗过程中关注的问题。伴随着以NGS为基础的液体活检在临床中应用,这个问题也逐渐得到解答。求臻医学特邀青岛大学附属医院肿瘤内科于壮教授,结合近期发表在Clinical Cancer Research杂志上的文章进行解读。
于壮教授:今天分享的这篇有关ctDNA水平动态变化可预测EGFR-TKI一线治疗后患者生存获益的前瞻性研究,再次验证了以NGS为基础的液体活检可以助力临床寻找提示EGFR TKI预后的生物标志物。
本研究患者来源于SWOG 1403研究,入组了106例未经EGFR-TKI治疗的EGFR敏感突变、且一线接受二代EGFR-TKI阿法替尼(±西妥昔单抗)治疗的NSCLC患者。基线时(治疗开始前),77%患者存在血浆ctDNA可检测到的EGFR突变,与脑和/或肝转移、M1B分期相关。治疗8周后ctDNA检测中EGFR突变完全清除患者组疾病进展风险显著降低,mPFS为15.1个月,而未清除患者组mPFS 4.6个月(HR=0.23,p<0.0001 );死亡风险亦显著降低,治疗8周后ctDNA检测中EGFR突变完全清除患者组mOS为32.6个月,未清除患者组mOS为15.6个月(HR=0.44,p=0.02)。同时注意到,肿瘤影像学应答与C3D1时ctDNA清除/存在无关,治疗后影像学评估结果并不能预测患者PFS,提示ctDNA清除更能预测患者靶向治疗后的长期获益。
总之,ctDNA中治疗相关基因突变丰度的动态变化可作为EGFR TKI疗效的早期预测指标;治疗8周后血浆中EGFR 突变清除状态与患者使用EGFR TKI后 PFS以及OS显著相关,血浆中EGFR 突变清除越早,患者的PFS及OS越长。以NGS为基础的液体活检逐渐在NSCLC临床诊疗中的应用,不仅能给临床提供精准用药参考,同时也会发掘越来越多靶向用药之后的预后标志物,在治疗早期即可监测和预判疗效以此帮助NSCLC患者及时改变治疗策略,为NSCLC患者带来更加精准和个体化的治疗参考,使其生存获益最大化。
摘要
本研究通过在SWOG S1403研究中进行连续ctDNA监测,发现基线ctDNA检测中77%存在EGFR突变,与脑和/或肝转移、M1B分期相关。
治疗8周后ctDNA检测中EGFR突变完全清除患者组疾病进展风险显著降低,mPFS为15.1个月,而未清除患者组mPFS 4.6个月 ;死亡风险亦显著降低,治疗8周后ctDNA检测中EGFR突变完全清除患者组mOS为32.6个月,未清除患者组mOS为15.6个月。因此,ctDNA动态变化可作为疗效的早期预测指标;治疗8周后血浆EGFR ctDNA的完全清除与较好的PFS及OS显著相关,可预测患者的长期获益。
研究背景
循环肿瘤DNA(ctDNA)特指坏死或凋亡的肿瘤细胞释放到外周血中的肿瘤DNA。在晚期NSCLC中,ctDNA已被证实可以用于检测驱动基因突变情况并指导靶向治疗决策。此外,还可用于明确肿瘤进展的耐药机制、预测疗效、以及根治术后作为早期肿瘤残留的标志物。包含NGS在内的现代分析技术可通过突变等位基因频率(MAF)对ctDNA进行定量。越来越多证据表明利用MAF可进行疗效预测,治疗相关基因MAF下降与较好的预后相关。
既往研究已证明泛HER-TKI阿法替尼联合靶向EGFR靶向单克隆抗体西妥昔单抗在EGFR 突变阳性且对EGFR-TKI获得性耐药患者中有一定疗效。S1403研究假设此两种药物联合应用于一线治疗可延迟或消除获得性耐药的发生。患者随机分入阿法替尼单药组或两药联合组。通过前瞻性动态收集患者血浆ctDNA,探索ctDNA MAFs水平变化与预后之间的关联。
研究方法
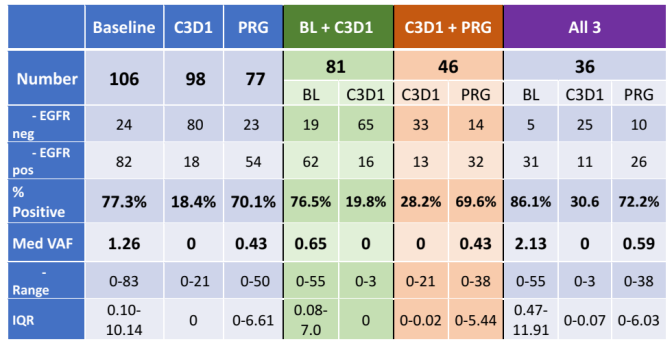
患者来源于S1403研究,皆为经组织检测为EGFR突变阳性的晚期NSCLC患者。在基线时(BL)、治疗后8周(C3D1)、疾病进展时(PRG)收集患者血浆,进行ctDNA分析。但并非每位患者都能采集到所有时间点的血样,具体信息见表1。在EGFR突变阳性病例中进行MAF水平定量检测和分析。
研究结果
ctDNA中的EGFR突变
106例收集到基线血浆样本的患者,89例存在对应肿瘤组织样本可用于证实其EGFR突变状态。106例患者中,基线时77%患者存在血浆ctDNA EGFR突变;C3D1及PRG时,分别有18%、70%患者存在可检测的ctDNA(详见表1)。
表1. 连续血浆收集
基线ctDNA:基线特征与临床预后
年龄较小、存在脑和/或肝转移、M1B分期与基线ctDNA EGFR突变检出相关(p<0.05),但EGFR突变类型未见差异。具体信息详见表2。经CNV校正后发现基线较高的EGFR MAF水平会增加59%的疾病进展风险和53%的死亡风险 (PFS HR = 1.59, 95% CI: 1.21 - 2.07, p = 0.0007; OS HR = 1.53, 95%CI: 1.10–2.13, p = 0.0108)。
表2. 入组患者基线特征

治疗相关MAFs水平变化
EGFR突变ctDNA检测流程见图1A。BL时血浆样本可检测到EGFR突变的患者,在BL、C3D1和 PRG时间点的EGFR MAF水平通常呈“V”形,即 EGFR MAF在治疗后降低,在疾病进展时反弹。
图1 B、图1C显示EGFR MAF水平随治疗时间的变化,C3D1时,ctDNA中EGFR突变清除者为蓝色, EGFR突变未清除者为红色。
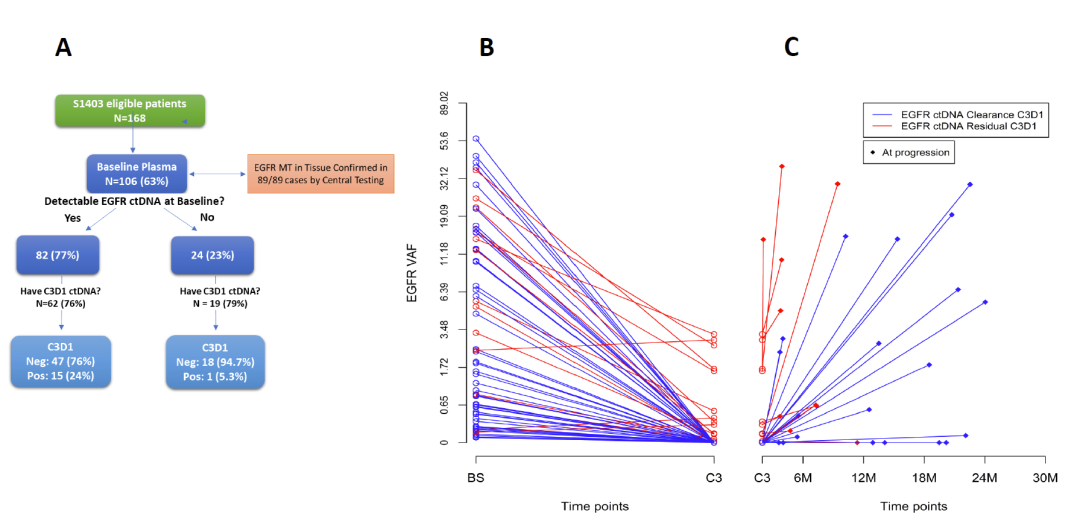
图1. A. ctDNA检测流程;EGFR MAFs在不同时间(B. BL-C3D1; C. C3D1-PRG)的水平变化
血浆EGFR突变清除及临床预后
基线血浆样本EGFR突变阳性患者,C3D1时ctDNA清除与疾病进展风险下降相关,mPFS为15.1个月;ctDNA未清除者mPFS仅为4.6个月(HR=0.23,p<0.0001,图2A)。C3D1时ctDNA清除与死亡风险下降亦相关,mOS为32.6个月;ctDNA未清除者mOS仅为15.6个月(HR=0.44,p=0.02,图2B)。这类相关性与治疗分组及EGFR突变类型均无关。
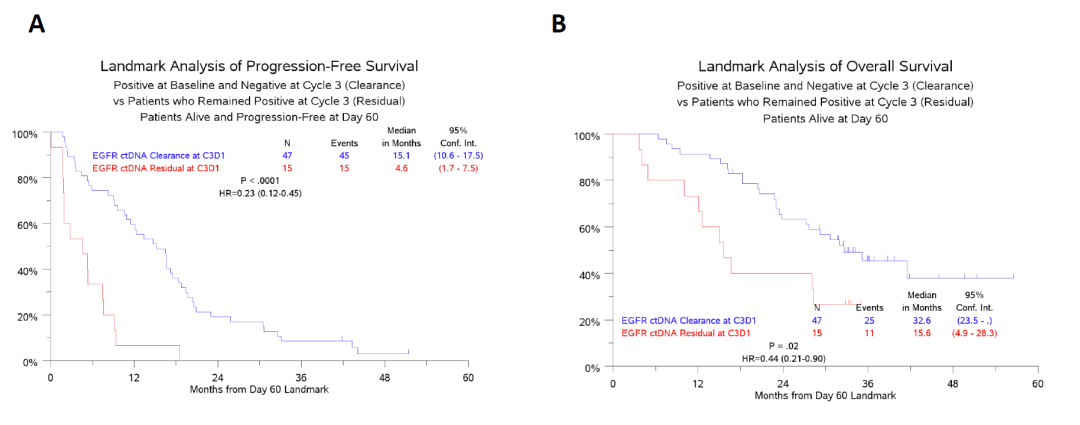
图2. C3D1时,ctDNA中EGFR MAF清除/未清除患者的:A.PFS; B.OS
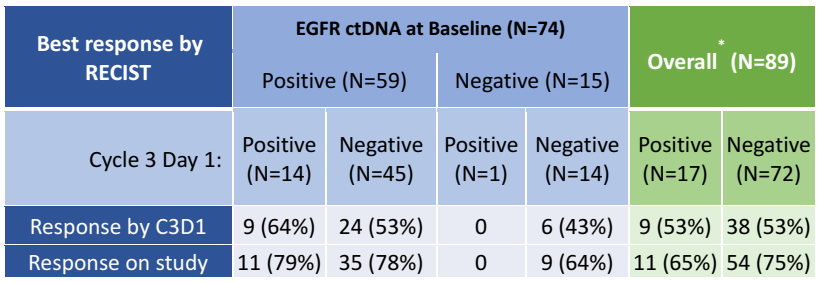
通过治疗后8周首次疾病评估和治疗期间任意时间的最佳疾病应答这两种方式对血浆清除及疾病应答之间的关系进行评估。发现以上两种情况中,肿瘤影像学应答均与C3D1时ctDNA清除/存在无关(表3)。
表3. RECIST影像学应答及ctDNA清除之间的关联
EGFR拷贝数扩增(CNG)与EGFR MAF相关
EGFE CNG阳性患者与EGFE MAF水平升高存在显著相关性(图3A)。BL 时EGFR CNG阳性患者的平均MAF为27.3%,而阴性患者仅为2.1%。图3B、图3C显示ctDNA中EGFR CNG阳性患者的预后较阴性患者差(PFS: HR=1.42 , p = 0.14; OS: HR=1.74 , p = 0.05)。
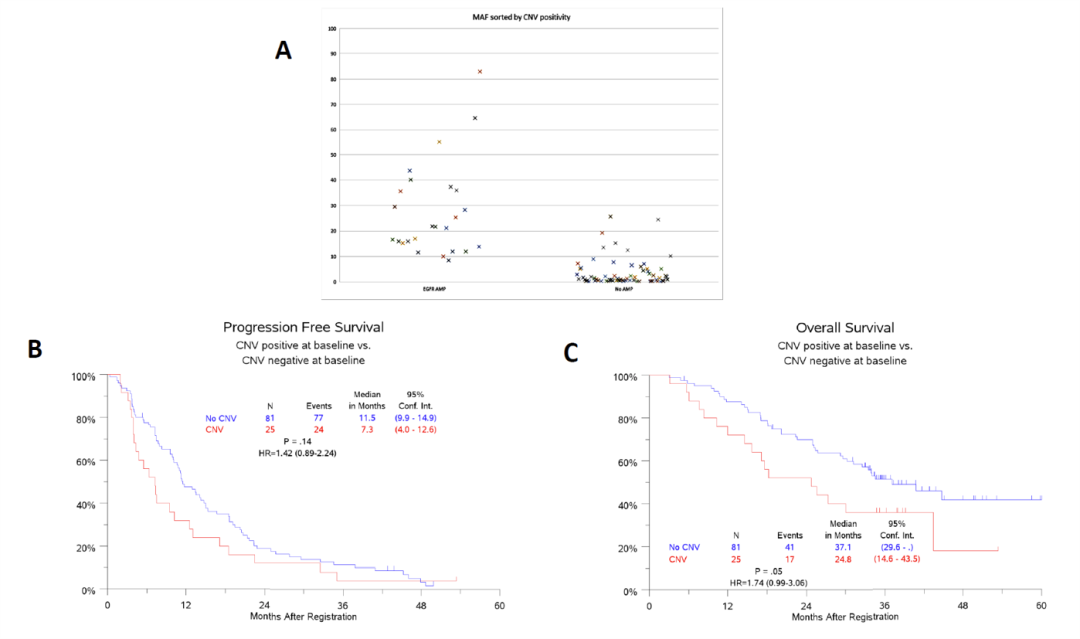
图3. A. EGFR CNG阳性/阴性患者的EGFR MAF(Y轴)分类;不同CNG患者的B. PFS; C.OS
讨论
本研究证实早期ctDNA中EGFR突变水平变化可有效预测S1403研究入组患者的长期预后。本研究入组患者均为EGFR敏感突变、未经EGFR-TKI治疗,一线接受二代EGFR-TKI阿法替尼(±西妥昔单抗)治疗的患者。基线时(治疗开始前),77%患者存在血浆ctDNA可检测到的EGFR突变。治疗8周后ctDNA中EGFR突变清除患者组的mPFS为15.1个月;相反,未清除患者mPFS仅为4.6个月(HR=0.23,p<0.0001)。ctDNA清除与PFS之间的相关性与用药分组及EGFR突变状态均无关。因此,在治疗后首次影像学评估时,ctDNA清除与RECIST影像学相比更能预测患者的PFS。在OS方面亦如此:治疗8周后,ctDNA中EGFR突变清除患者组mOS为33个月,未清除患者组mOS仅为15.6个月(HR=0.44,p=0.02)。
血浆ctDNA清除仅在基线ctDNA MAFs阳性患者中进行评估。S1403研究中,所有患者均为组织检测EGFR阳性后入组,77%患者检出血浆EGFR突变阳性,表明基线EGFR MAFs阴性病例ctDNA释放率低,这与肿瘤分期相关,M0/M1A期(复发或肺内局部转移)患者基线ctDNA检出频率较M1B期(至少2处远处转移)患者显著降低(60% vs 87%,p=0.001)。Aggarwal等人也报告类似结果。
ctDNA MAFs的另一个影响因素为基因扩增。在EGFR突变肺腺癌中,EGFR基因扩增阳性率大于30%。本研究中,在基线ctDNA中EGFR突变阳性患者中,24%病例中存在血浆EGFR CNG。进一步研究发现,基线EGFR CNG阳性与OS显著缩短相关。然而,本研究中所有患者均存在EGFR突变,且应用EGFR-TKI治疗,因此很难确定EGFR CNG是否为与基线ctDNA检测相关的预后因素。但仍为血浆ctDNA中CNG检测提供依据,对于ctDNA水平动态变化领域的发展具有重要意义。