
与临床研究相比,真实世界中的转移性尿路上皮癌(mUC)患者通常体力评分更差,并不适合一线化疗。在真实世界中不同肿瘤突变负荷(TMB)是否可指导顺铂不耐受患者的一线治疗决策值得研究。求臻医学特邀上海市第六人民医院泌尿外科陈嵘教授,结合近期发表在JCO Precision Oncology杂志上的文章进行解读。
陈嵘教授:近30年来,以铂类为基础的联合化疗方案是转移性尿路上皮癌(mUC)的标准一线治疗方案,有效率可达50%,但由于顺铂的副作用较大,部分患者并不能耐受,临床会改为以卡铂为基础的化疗方案或非铂类化疗为主,导致疗效有所降低。随着免疫治疗的快速发展,2017年,基于IMvigor210和 KEYNOTE-052单臂Ⅱ期临床研究结果,FDA加速批准阿替利珠单抗和帕博利珠单抗用于不能耐受顺铂化疗患者的一线治疗。那么对于顺铂不耐受患者,卡铂为基础的联合化疗和免疫治疗之间孰优孰劣,答案尚且未知。
近期有研究团队在JCO Precision Oncology杂志上发表了一项研究结果,或许可为顺铂不耐受mUC患者一线治疗方案的选择提供参考。文章对比了真实世界中不同肿瘤突变负荷(TMB)的顺铂不耐受mUC患者接受单药免疫检查点抑制剂(ICPI)及卡铂为基础的化疗的预后。研究入组401例mUC患者,245例接受单药ICPI治疗,156例接受卡铂为基础的化疗,患者组织样本经NGS检测获得TMB信息。研究结果显示在一线接受ICPI单药治疗的患者中,TMB≥10的患者无进展生存期(PFS)(HR= 0.59; P =0 .0048)、至下一治疗时间(TTNT)(HR=0.59; P =0 .0020)、总生存期(OS)(HR= 0.47; P = 0.0001)均优于TMB<10患者。TMB≥10的患者接受单药ICPI治疗的PFS(HR= 0.51; P =0 .0058)、TTNT(HR=0.56; P =0 .0197)、OS(HR= 0.56; P = 0.084)优于卡铂为基础的化疗,但TMB<10的患者中并无优势。上述研究表明真实世界中,TMB或可指导顺铂不耐受mUC患者的一线治疗,TMB ≥ 10更能从一线单药ICPI治疗中获益。因此,在临床上对于不耐受顺铂的mUC患者,可考虑使用NGS大panel检测,明确TMB情况,进而在卡铂化疗及单药ICPI治疗中做出更为高效低毒的选择,为mUC患者带来更为显著的生存期及生活质量层面获益。
摘要
与临床研究相比,真实世界中的转移性尿路上皮癌(mUC)患者通常体力评分更差,并不适合一线化疗。本研究意在探寻在真实世界中TMB是否可指导顺铂不耐受患者的一线治疗决策。本研究入组401例mUC患者,245例接受单药ICPI治疗,156例接受卡铂为基础的化疗,患者组织样本经NGS检测获得TMB信息。
研究结果显示:30.4%患者TMB≥10。在一线接受ICPI单药治疗的患者中,TMB≥10的患者PFS(HR= 0.59; P =0 .0048)、TTNT(HR=0.59; P =0 .0020)、OS(HR= 0.47; P = 0.0001)均优于TMB<10患者。经校正后,TMB≥10的患者接受单药ICPI治疗的PFS(HR= 0.51; P =0 .0058)、TTNT(HR=0.56; P =0 .0197)、OS(HR= 0.56; P = 0.084)优于卡铂为基础的化疗,但TMB<10的患者中并无优势。本研究提示真实世界中,TMB或可指导顺铂不耐受mUC患者的一线治疗,TMB ≥ 10更能从一线单药ICPI治疗中获益。
研究背景
长期以来,以顺铂为基础的化疗是mUC患者的标准一线治疗,但部分患者由于体力状态评分较差、慢性肾脏疾病、心衰等因素无法耐受顺铂或卡铂化疗(即cisplatin-unfit患者)。2017年,基于IMvigor210和 KEYNOTE-052单臂Ⅱ期临床研究结果,FDA加速批准阿替利珠单抗和帕博利珠单抗用于不能耐受顺铂化疗患者的一线治疗,但之后的Ⅲ期临床研究却提示单药阿替利珠单抗或帕博利珠单抗与标准化疗组相比疗效并无统计学差异,临床急需分子标志物用于鉴别从单药ICPI治疗中获益的优势人群。PD-L1表达在Ⅲ期临床研究的患者筛选中并未得到一致性结论,寻找新的可替代生物标志物迫在眉睫。已有研究显示高TMB(TMB ≥ 10 mut/MB)mUC患者接受ICPI的预后较好,但TMB检测平台,算法和阈值无统一标准,且无高TMB患者与标准治疗相比的头对头研究。本研究比较真实世界中不同TMB的顺铂不耐受mUC患者接受单药ICPI对比化疗的预后,以评估TMB≥10是否能预测ICPI获益。
研究方法
研究纳入2011年1月至2021年4月接受一线单药ICPI(帕博利珠/阿替利珠/纳武利尤/德瓦鲁/阿维鲁单抗)或卡铂基础化疗的mUC患者,组织样本均经过Foundation Medicine进行基因检测获得 TMB信息。评估患者的PFS、TTNT及OS。流程图见图1。
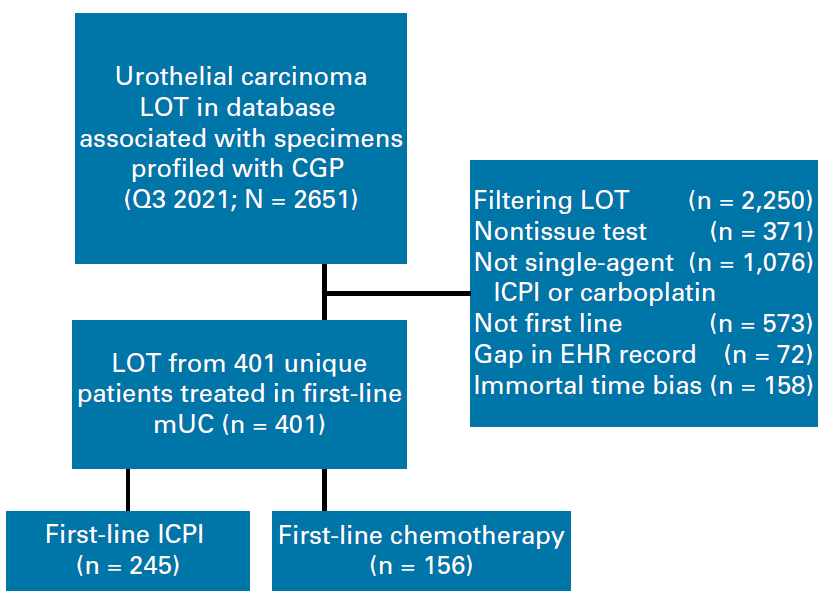
图1. 患者筛选及分组流程
研究结果
患者基线特征
研究共纳入401例患者,245例接受单药ICPI治疗,156例接受卡铂为基础的化疗(图1、表1)。ICPI组患者中位年龄较高(73岁vs 69岁,P<0.001)、初诊分期较早(P<0.001)、ECOG评分较差(P<0.001)。化疗组患者后续治疗方案多样,后续单药ICPI治疗比例较高(41.7% vs3.7%)。30.4%患者的TMB≥10。
表1. 患者基线临床特征及治疗亚组
TMB≥10患者的PFS、TTNT、OS
如图2A-2C所示,TMB≥10的ICPI组患者PFS(HR= 0.59; P =0 .0048)、TTNT(HR=0.59; P =0 .0020)、OS(HR= 0.47; P = 0.0001)均优于TMB<10患者。
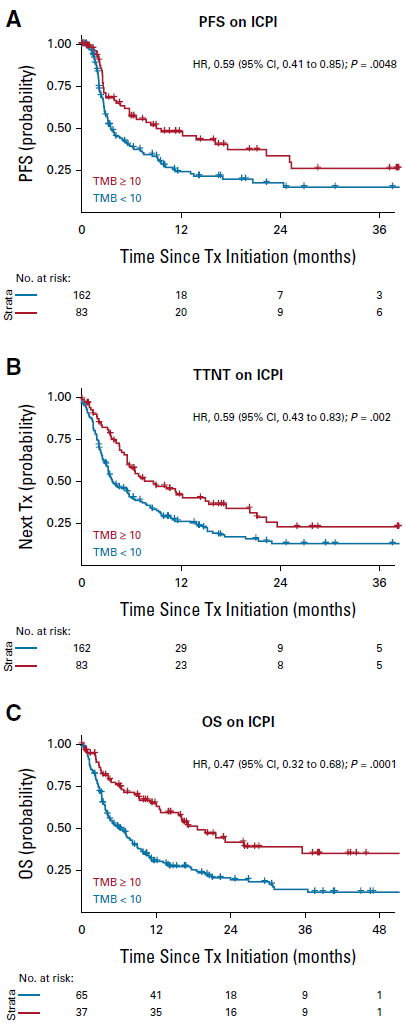
图2. 一线单药ICPI组、TMB≥10患者的PFS、TTNT、OS均优于化疗组相应患者
经校正后,患者中单药ICPI治疗并未优于化疗(图3)。
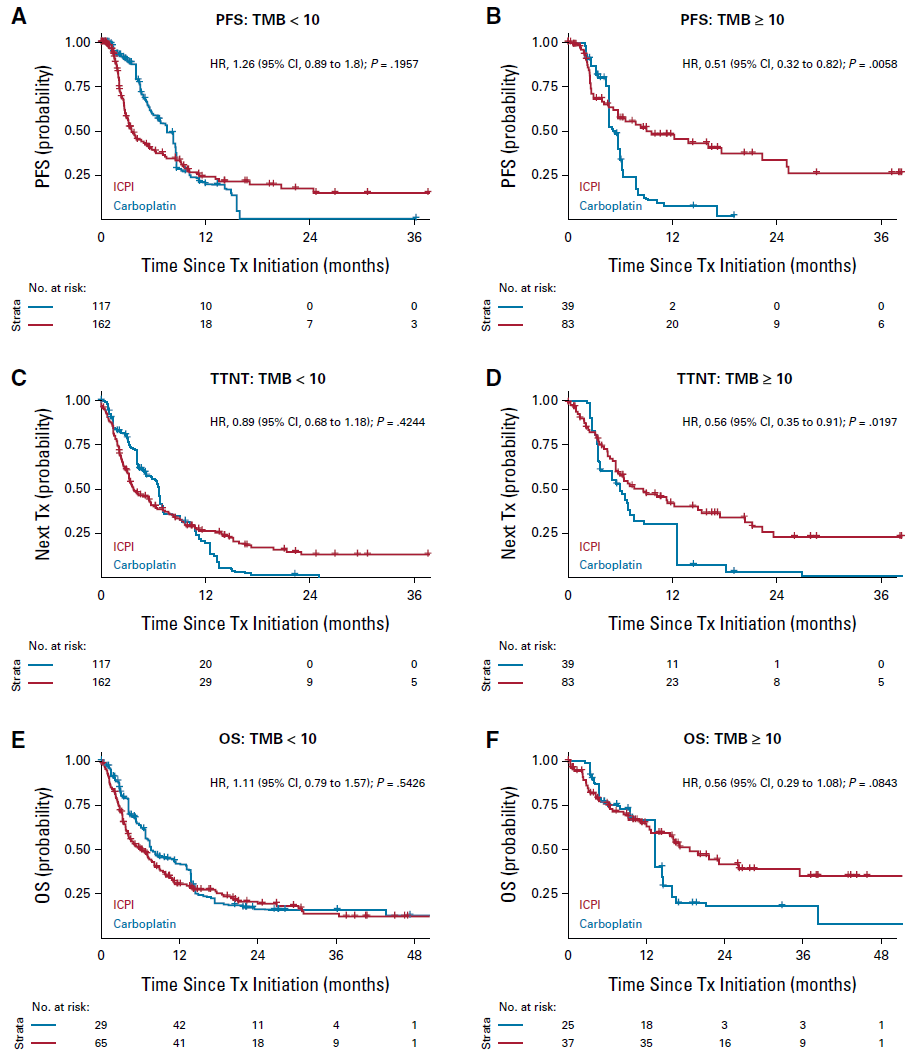
图3. 校正分析后显示一线单药ICPI组、TMB≥10患者的PFS、TTNT、OS较化疗组患者更加获益
TMB与PD-L1
研究还比较了经TMB或PD-L1分层的亚组结果。仅35.7%患者可评估PD-L1状态。结果显示尽管PD-L1的置信区间范围较大,但PD-L1表达阳性,评分≥10对于患者PFS、TTNT及OS的预测能力劣于TMB≥10(图4A-4C)。
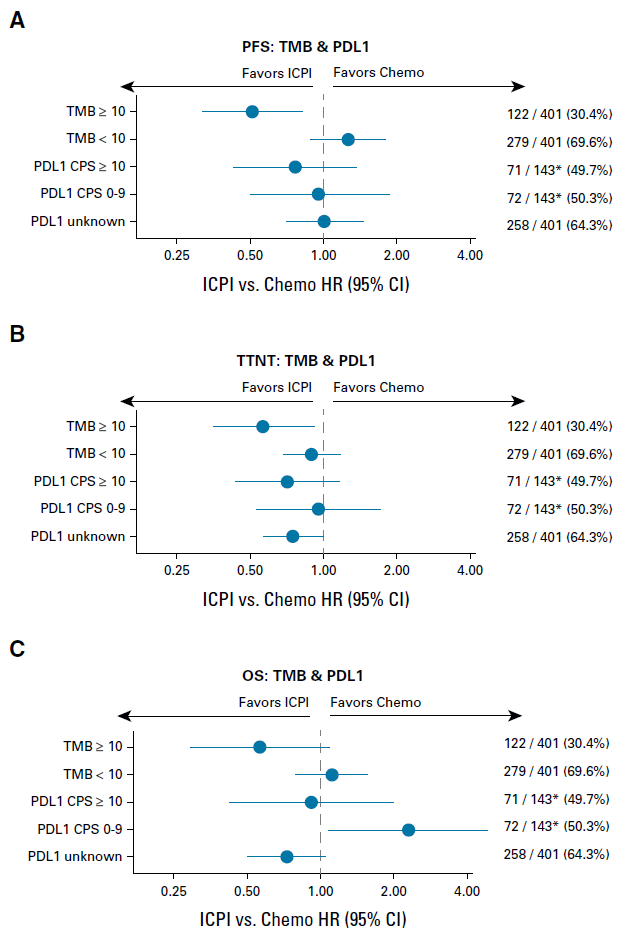
图4. TMB与PD-L1的对比
研究人群与RCT人群对比
将ECOG评分作为患者虚弱状态的指标,比较一线治疗中本研究队列及其他RCTs研究患者的特征(图5A)。DANUBE研究、IMvigor130研究、KEYNOTE-361研究中ECOG评分=0的患者分别为53.2%、52.2%、44.8%,但本研究中这个比例仅为0.3%;ECOG评分=2的患者分别为53.20%、10.8%、6.9%,本研究中为42.3%;无RCT研究纳入ECOG评分≥3的患者,本研究中ECOG评分≥3的患者比例高达19.2%。
研究进一步比较真实世界及RCT中经TMB分层后ICPI对比化疗的疗效,发现结论相一致,与一线卡铂为基础的化疗相比,TMB≥10亚组患者一线接受ICPI更为获益(图5B、图5C)。
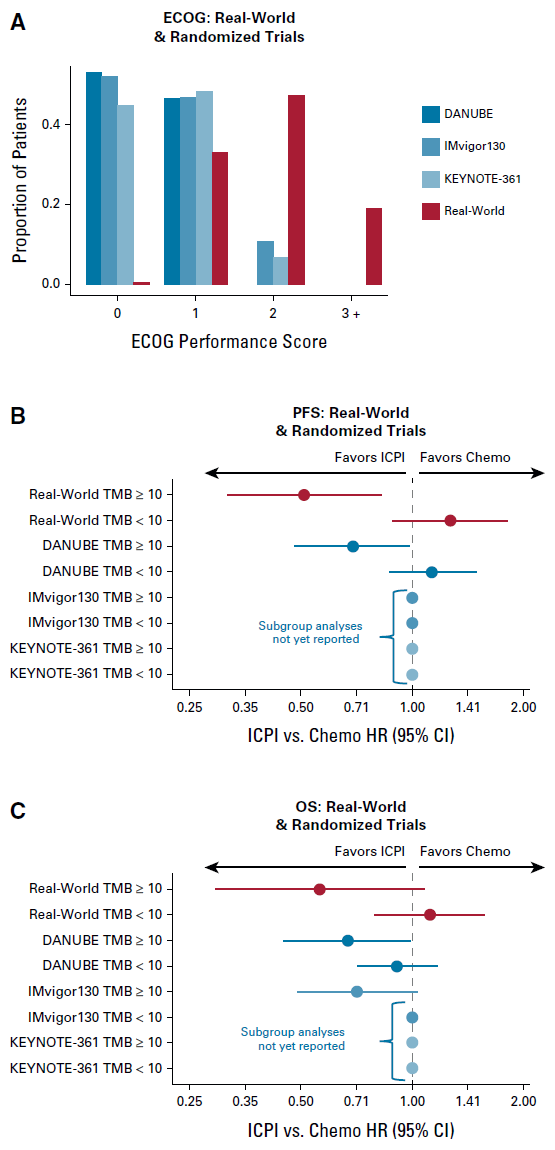
图5. 真实世界与随机对照研究的亚组分析
讨论
真实世界中,TMB≥10患者一线接受ICPI治疗的预后优于TMB<10患者(图2)。且TMB≥10患者接受单药ICPI治疗的预后优于卡铂为基础的化疗,而在TMB<10患者中并未观察到此现象(图3、图4)。这与RCTs中不同人群的亚组分析结论一致(图5)。
铂类化疗序贯阿维鲁单抗已成为mUC患者的标准治疗模式。但由于mUC患者中位年龄高达73岁、体力状态较差、且存在多种重要器官合并症,大多数无法耐受化疗。目前尚无预测生物标志物可用于mUC患者一线治疗是选择化疗还是单药ICPI治疗,尤其是顺铂不耐受患者。经过本研究验证发现,TMB可能在筛选单药ICPI治疗获益人群中发挥作用。
由于合并症的存在(例如心肾疾病、自身免疫性疾病)及较差的体力状态评分,mUC患者通常无法参加临床试验。本研究中也观察到此现象(图5),真实世界与临床研究中不同ECOG评分的患者分布存在极大差异。而这些因素直接影响临床治疗决策的有效性,造成临床研究与标准治疗之间的差异。
既往mUC患者的真实世界研究显示,接受单药ICPI治疗患者的初始OS劣于化疗组,而长期OS优于化疗组,与DANUBE研究、IMvigor130研究及KEYNOTE-361研究结果相一致。本研究中未经TMB分层的结果亦如此。但即使在TMB≥10亚组中,也有患者ICPI治疗后疾病快速进展。但就总体而言,TMB≥10的mUC患者接受ICPI单药治疗的PFS、TTNT、OS均优于卡铂为基础的化疗。IMvigor130研究及DANUBE研究亚组分析亦验证此结果。尽管TMB在预测ICPI获益方面仍有不足之处,但其或可为顺铂不耐受患者在一线治疗中是选择单药ICPI治疗还是其他铂类化疗提供理论依据。
TMB检测的金标准为全外显子测序。然而,商业化全外显子测序的报告周期约2-3周,对于进展期或专营患者的治疗决策制定并不适用。例如NGS大panel进行TMB检测的周期较短,以FoundationOneCDx为例,约为10.9天。
目前mUC的标准治疗已更新为化疗后序贯ICPI治疗。但患者对于单药ICPI的耐受性整体优于化疗,筛选顺铂不耐受患者中单药免疫治疗的优势人群可为部分患者在不影响预后的情况下规避化疗的不良反应,而TMB或许是一个可预测单药ICPI获益的有效生物标志物。






