近年来,伴随肿瘤靶向、免疫、核素治疗的发展,泌尿肿瘤领域取得长足进步。特别是以基因检测为代表的精准医学在泌尿肿瘤中的广泛应用,正在快速改变泌尿肿瘤领域诊疗模式。求臻医学聚焦重磅研究,紧追前沿热点,对泌尿肿瘤领域前沿进展进行梳理,特推出“探泌臻知”系列栏目。本期收官之作,我们将着重介绍肾癌分子分型及应用,快跟随求小臻一起学习吧~
肾癌预后与初诊时临床分期、分级息息相关,I-II期的5年生存率可以达到90%以上,而IV期患者的5年生存率不超过20%[1]。大约 25% 的肾癌患者在初始诊断时出现转移性疾病,而有另外30%的患者,在经过根治术后发生复发转移。患者一旦出现转移则生存较差,中位五年生存率低于10%,只能通过全身系统的治疗,控制疾病的进展[2]。
在过去十年中,FDA批准了多种酪氨酸激酶抑制剂(tyrosine kinase inhibitors, TKI)、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)抑制剂和免疫检查点抑制剂治疗转移性肾癌。随着精准医疗的快速发展,个性化治疗方案逐渐成为肿瘤治疗的趋势。面对这些日益增多的治疗选择,如何更好地了解晚期肾癌患者临床异质性的分子基础及耐药机制,进而精准选择临床治疗策略是未来的研究重点。
肾癌RNA分子分型的临床价值
近年来,越来越多的研究基于RNA层面对影响TKI及免疫治疗疗效的因素进行探索。下面将对几项大型研究进行详细解读,发掘肾癌分子分型对于晚期肾癌治疗的指导价值。
1.COMPARZ:RNA四分型
一项于2019年发表于“Cancer Discovery”上的研究[3],选取了COMPARZ III期临床试验中的数据,对409例患者(212例舒尼替尼,197例培唑帕尼治疗)的临床数据进行NMF聚类,并根据1500个最易变基因确定了4个生物学上不同的聚类,如下表1所示。
表1. 不同亚型的特征和预后

随后该研究对Cluster 4在接受TKI治疗后不良预后的原因进行了分析,发现血管生成(Angiogenesis)和巨噬细胞浸润(Macrophage infiltration)可能是影响TKI治疗反应的重要机制。培唑帕尼治疗的患者中,低血管生成、高巨噬细胞浸润的患者OS和PFS最差。但是,在舒尼替尼治疗的患者中,血管生成、巨噬细胞浸润情况不同组合的患者的OS或PFS没有显著区别(图1)。该研究表明,血管生成和巨噬细胞浸润程度是 TKI 治疗结果强有力的预测因子,但预测能力因TKI类型而异。高血管生成、低巨噬细胞浸润的患者可能单独从培唑帕尼中获益;高血管生成、低/高巨噬细胞浸润的患者可能受益于舒尼替尼联合巨噬细胞定向免疫治疗(如 CSF1R 抑制);低血管生成、高巨噬细胞浸润的患者则可能受益于CSF1R抑制剂。
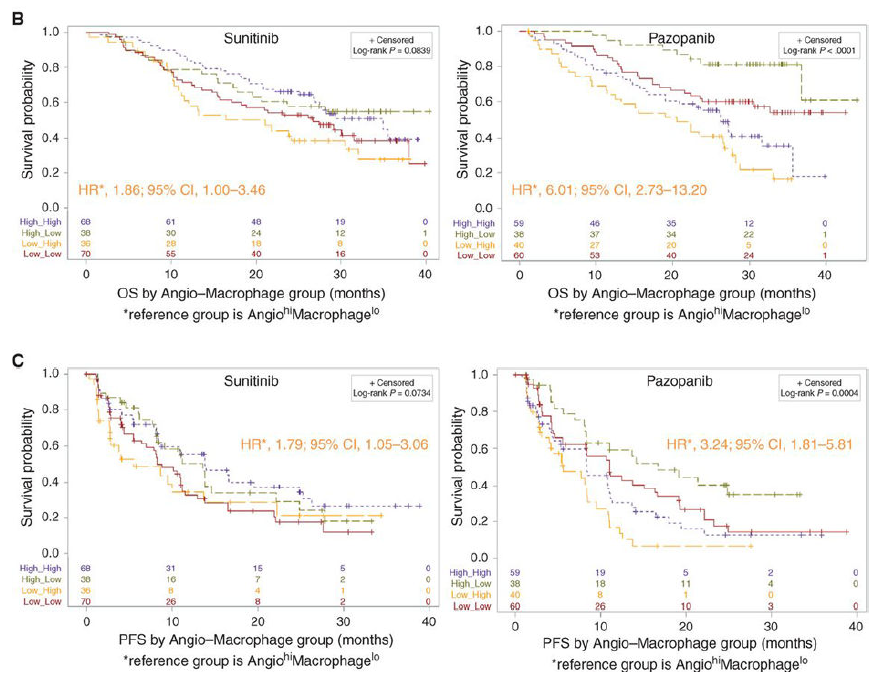
图1. 血管生成和巨噬细胞浸润对接受舒尼替尼(左)和培唑帕尼(右)治疗患者的总生存期(OS) /无进展生存期(PFS)影响
2.BIONIKK:RNA四分型
一项于2022年发表于“Lancet Oncology”上的BIONIKK研究,是一项生物标志物驱动的、开放标签、非比较的随机Ⅱ期研究,对既往未接受治疗的转移性ccRCC患者基于分子亚型进行随机分组[4]。该团队之前基于转录组数据构建了一种 基于35 个基因的表达分类器,可在转移性透明肾细胞癌中识别4个具有不同肿瘤微环境和对舒尼替尼有不同敏感性的透明肾细胞癌亚组:ccrcc1亚组为免疫沙漠型,对舒尼替尼反应较差,具有低免疫肿瘤微环境;ccrcc2亚组为促血管生成型,对舒尼替尼最为敏感,近一半表达高血管生成和高免疫信号;ccrcc3亚组为正常样,对舒尼替尼反应良好,分子和病理特征与正常肾组织最接近;ccrcc4亚组为免疫浸润和炎症型,对舒尼替尼反应较差,具有炎性和高免疫肿瘤微环境。ccrcc1和ccrcc4型的患者随机1:1分配接受纳武利尤单抗vs 纳武利尤单抗+伊匹木单抗;ccrcc2和ccrcc3型的患者随机1:1分组接受VEGFR(血管内皮生长因子受体)-TKI(如舒尼替尼或培唑帕尼) vs纳武利尤单抗+伊匹木单抗治疗。
在 ccrcc1 亚组中,纳武利尤单抗组的客观缓解率(ORR)为29%,纳武利尤单抗+伊匹木单抗组的ORR为39%。在 ccrcc2 亚组中, VEGFR-TKI 组的ORR为50%,纳武利尤单抗+伊匹木单抗组的ORR为51%。在 ccrcc3 亚组中, VEGFR-TKI 组的ORR为0%,纳武利尤单抗+伊匹木单抗组的ORR为20%。在 ccrcc4亚组中,纳武利尤单抗组的ORR为44%,纳武利尤单抗+伊匹木单组的ORR为50%(图2)。中位PFS在ccrcc1亚组中,纳武利尤单抗组为5.2个月,纳武利尤单抗+伊匹木单抗组为7.7个月。在ccrcc4亚组中,纳武利尤单抗组为7.8个月,纳武利尤单抗+伊匹木单抗组为13.0个月。在ccrcc2亚组中,TKI组 为14.4个月,纳武利尤单抗+伊匹木单抗组为11.1个月(图3)。在ccrcc3亚组中,TKI组为 3.2个月,纳武利尤单抗+伊匹木单抗组 为16.1个月。
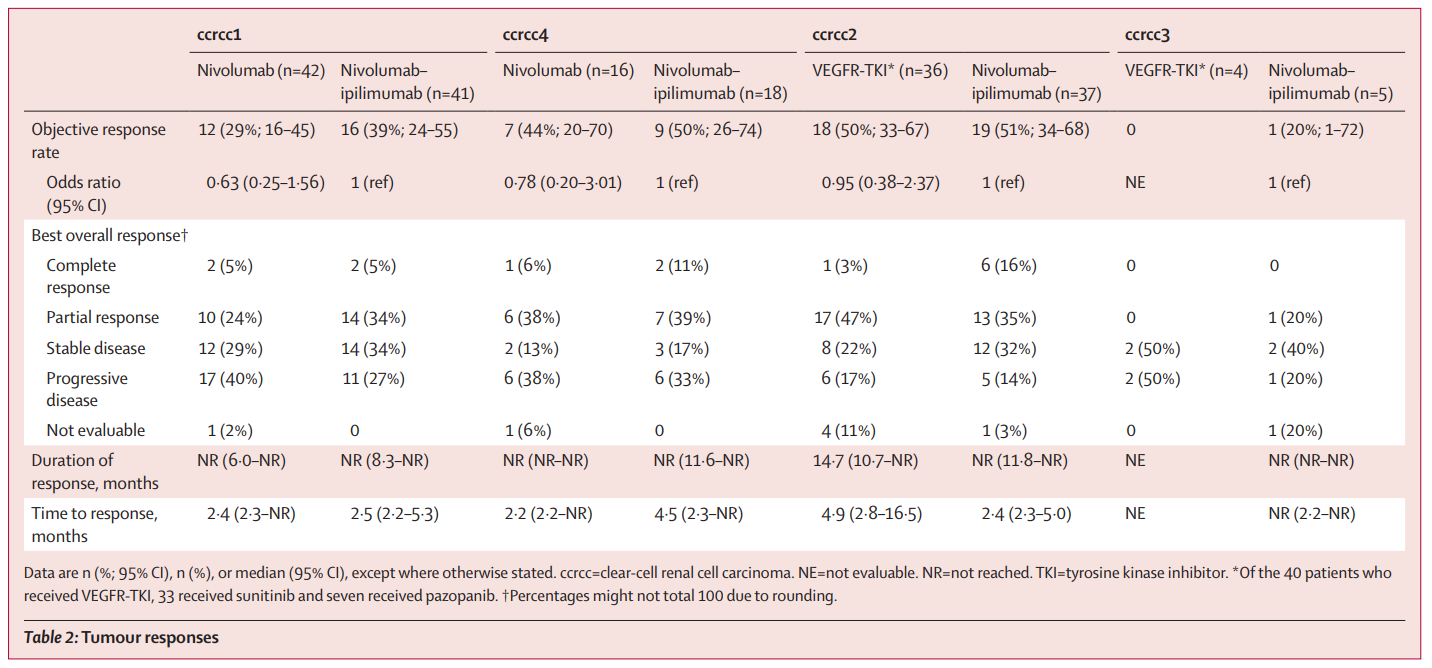
图2. BIONIKK研究中的ORR
在免疫沙漠ccrcc1组中,与单独使用纳武利尤单抗相比,纳武利尤单抗+伊匹木单抗组的客观缓解率(ORR)增加,PFS更长。在免疫浸润性和炎症性ccrcc4组中,纳武利尤单抗组和纳武利尤单抗+伊匹木单抗组的ORR都很高。并且在ccrcc4组中,两个基于纳武利尤单抗的治疗方式都显示出比ccrcc1组或其他未选择患者的预期队列更高的ORR和更长的PFS,是免疫治疗的最优人选。在促血管生成的ccrcc2组,VEGFR-TKI组和纳武利尤单抗+伊匹木单抗组都有较高的ORR,但VEGFR-TKI组的PFS优于纳武利尤单抗+伊匹木单抗组。ccrcc3型肿瘤的发生率低,样本量少,因此没有对这一亚组得出任何结论。若不考虑ccrcc分组,接受纳武利尤单抗+伊匹木单抗治疗的临床结果与关键试验CheckMate 214中的结果相似(ORR 42% mPFS 11.6m)[5],侧面印证了ccrcc4增加的ORR及延长的PFS可能与分子选择有关。
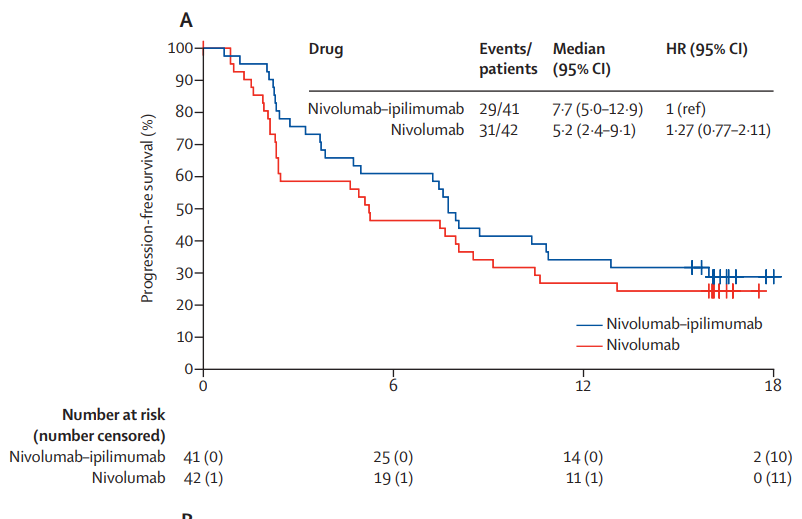
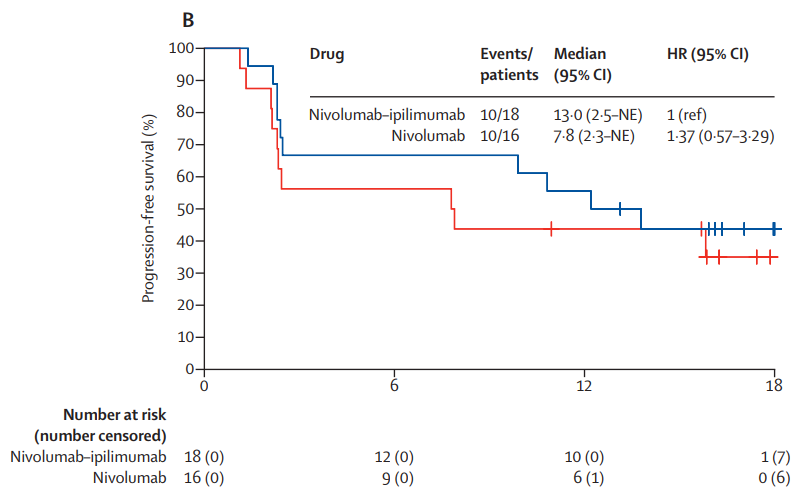

图3. ccrcc1组的PFS(A);ccrcc4组的PFS(B);ccrcc2组的PFS(C)
3.RNA七分型
另一项于2020年发表于“Cell Reports ”上的研究[6],选取III期临床试验(IMmotion151)中的数据,对823例晚期肾细胞癌患者的临床数据进行NMF聚类,并根据3074个最易变基因确定了7组亚型,分别为:血管生成/基底型(Angiogenic/Stromal)、血管生成型(Angiogenic)、补体/氧化型(Complement/Ω-oxidation)、T-效应细胞/增殖型(T-effector/Proliferativ)、增殖型(Proliferative)、基底/增殖型(Stromal/Proliferative)和snoRNA型(图4)。这7种亚型具有各自特异性的血管生成、免疫、代谢、基质和细胞周期特征,如下表2所示。
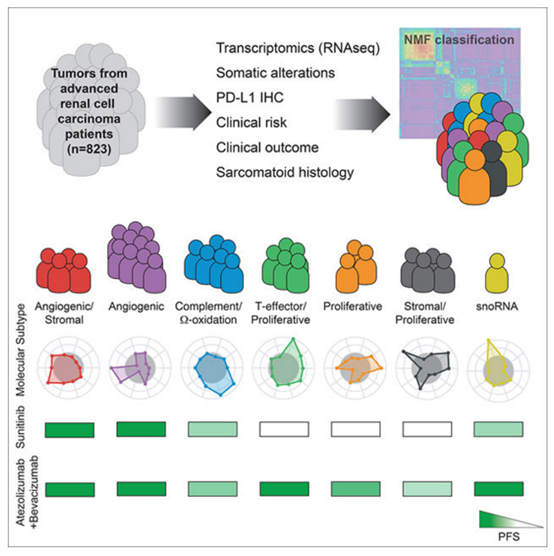
图4. 分子分型概要
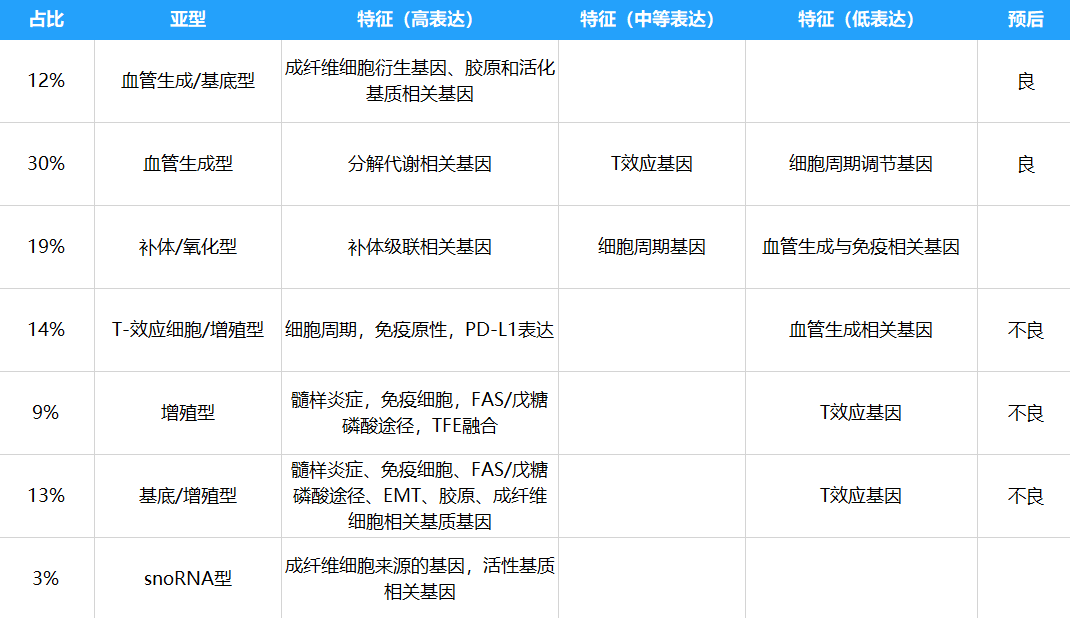
表2. 不同亚型的占比、特征和预后
该研究评估了7种亚型接受阿替利珠单抗+贝伐珠单抗的联合治疗和接受舒尼替尼单药治疗的临床结果。血管生成/基底型、血管生成型的患者使用两种治疗方式的PFS都较长,表明无论进行何种治疗,两种亚型的预后都更好;而基底/增殖型使用两种治疗方式的PFS都相对较短,表明该亚型的预后较差。T-效应细胞/增殖型和增殖型在接受联合治疗后的ORR和PFS均优于舒尼替尼;sonRNA型在接受联合治疗后的PFS更长。因此,T-效应细胞/增殖型、增殖型和sonRNA型更倾向于选择阿替利珠单抗+贝伐珠单抗的联合治疗。而在血管生成/基底型、血管生成型、补体/氧化型中两种治疗方式并无显著差异(图5)。该研究表明,舒尼替尼或阿替利珠单抗+贝伐珠单抗在高血管生成亚型中有效,阿替利珠单抗+贝伐珠单抗在高T效应和/或细胞周期转录的肿瘤中具有更高的临床获益。
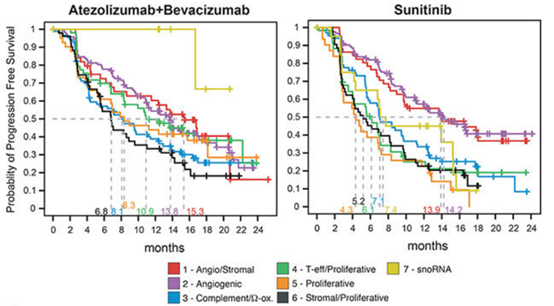
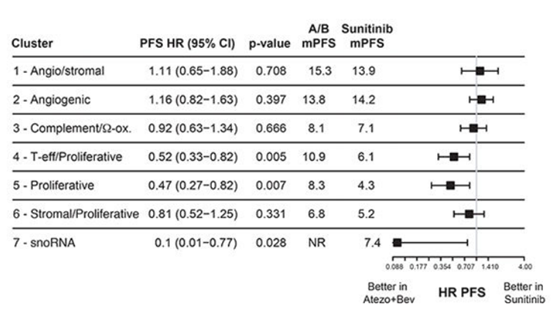
图5. 不同亚型对阿替利珠单抗联合贝伐珠单抗和舒尼替尼治疗的响应情况
总结
上述研究表明,不同亚型的患者不仅预后不同,对靶向或靶向联合免疫治疗的应答也不同。因此,RNA分子分型对晚期肾癌治疗的选择,具有重要的临床参考价值。虽然目前国内外指南和共识中尚未将RNA分子分型作为晚期肾癌治疗的参考依据,但基于转录组学的精准分型已是未来的发展趋势。求臻医学目前也在进行肾癌分子分型相关的临床研究,为肾癌的精准诊疗提供支持,进而延长晚期肾癌患者的生存期 。
往期精选






