臻知识·专家访谈 | 第36期

度伐利尤单抗巩固治疗可显著改善局晚期NSCLC预后,但仍有患者2年内局部复发,如何通过探寻疗效预测生物标志物,提前筛选巩固免疫治疗优势人群,帮助患者选择个体化治疗方案,是目前肿瘤精准治疗领域的重要课题。求臻医学特邀吉林大学第二医院王珂教授,结合近期发表在JAMA Netw Open杂志上的文章进行解读。
王珂教授:PACIFIC研究奠定了局部晚期NSCLC患者治疗新模式,度伐利尤单抗联合根治性同步放化疗显著改善局部晚期NSCLC患者疾病控制率和总生存期。但该研究的亚组分析发现PD-L1阴性及携带驱动基因突变的患者获益率较低,且临床实践中存在部分患者因严重的不良反应终止免疫治疗,因此如何通过生物标志物提前筛选巩固免疫治疗优势人群,使患者获益最大化,显得尤为重要。
近期在JAMA Netw Open杂志上发表的一篇文章试图通过对接受巩固免疫治疗的局部晚期NSCLC进行前瞻性基因组检测挖掘可预测疗效的生物标志物。该研究共纳入81例接受根治性放化疗和度伐利尤单抗巩固治疗的局部晚期NSCLC患者,比较不同TMB水平和基因组突变状态患者的疗效和预后。研究发现与TMB-L患者相比,TMB-H患者接受根治性放化疗和度伐利尤单抗巩固治疗后的24月局部治疗失败(LRF)率显著降低(TMB-H:51%;TMB-L:9%,P=0.001),24月无进展生存期(PFS)率显著提高(TMB-H:66%;TMB-L:27%;P=0.003)。与KEAP1/NFE2L2野生型患者相比,突变型患者的24个月LRF率显著提高(突变型:52%,野生型:27%;P=0.05)。但经单变量Cox比例风险回归模型分析后,只有TMB状态与LRF和PFS显著相关,其它基因突变状态和临床特征均与LRF和PFS无显著相关性。综上,TMB可助力局晚期NSCLC复发风险分层,指导患者的个体化巩固免疫治疗。
本研究是针对接受cCRT和度伐利尤单抗治疗的III期NSCLC患者的大规模基因组分析研究。研究发现TMB-H的患者从根治性放化疗后的巩固免疫治疗中获益概率高,而TMB-L患者需要更加强烈的治疗方式改善预后。联合TMB与KEAP1/NFE2L2突变状态可鉴别LRF低风险人群,TMB-H、KEAP1/NFE2L2野生型患者在治疗后的24个月出现LRF的几率仅为7%。上述结果为不可切除III期NSCLC患者基于肿瘤基因组学选择个体化治疗方案奠定基础。
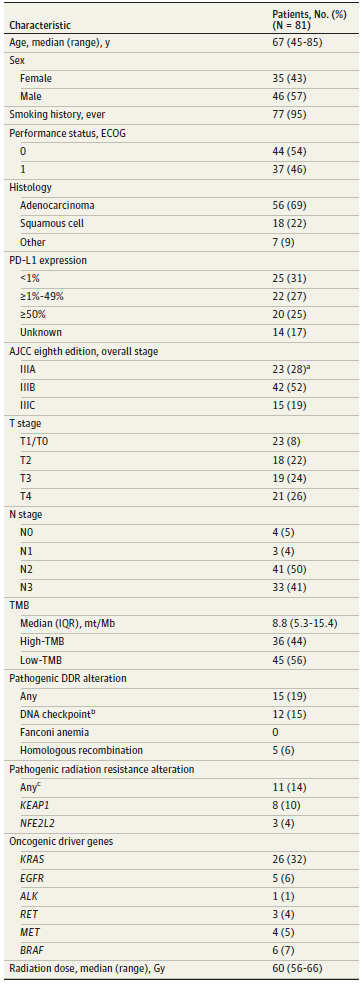
摘要 在放化疗基础上联合度伐利尤单抗巩固治疗可提高局部晚期NSCLC患者的疾病控制率及生存期,但仍需探寻疗效预测生物标志物。本研究纳入接受放化疗和度伐利尤单抗治疗的81例局部晚期NSCLC患者,比较不同TMB水平和基因组突变状态患者的24个月局部治疗失败率(LRF)及无进展生存率(PFS)。研究发现与TMB-L患者相比,TMB-H患者接受根治性放化疗和度伐利尤单抗治疗后的LRF和PFS均显著延长(LRF:9% vs 51%,P=0.001;PFS: 66% vs 27%,P=0.003)。TMB状态可能辅助不可切除的局部晚期非小细胞肺癌的风险适应性放疗决策。KEAP1/NFE2L2突变患者和野生型患者的24个月LRF分别为52%和27%(P=0.05)。经多因素校正后,只有TMB状态与LRF和PFS显著相关,其他基因突变状态和临床特征均与LRF和PFS无显著相关性。TMB可助力局晚期NSCLC复发风险分层,指导患者的个体化治疗。 研究背景 度伐利尤单抗联合根治性同步放化疗(cCRT)可改善局部晚期NSCLC患者疾病控制率及总生存期,但仍需可预测疗效的生物标志物进而指导个体化治疗。有研究表明TMB可预测放疗敏感性,但在cCRT联合度伐利尤单抗治疗中的预测作用未见报道。KEAP1/NFE2L2通路的致病性突变可导致放疗耐药,但突变患者接受cCRT联合度伐利尤单抗的局部疾病进展风险较单纯cCRT治疗降低。此外,DNA损伤修复(DDR)通路的致病性突变也可能与放疗敏感性相关。因此本文综合分析经cCRT和度伐利尤单抗治疗的III期NSCLC患者的TMB及放疗敏感性相关基因突变,探寻可指导个体化治疗的基因组生物标志物。 研究方法 回顾性分析2013年11月至2020年3月诊断为III期、接受根治性cCRT序贯度伐利尤单抗巩固治疗的NSCLC患者,患者均在治疗前接受基于原发灶组织的NGS检测。局部治疗失败定义为放疗开始直至患者死亡。含有放疗耐药基因(KEAP1/NFE2L2致病性突变)突变、DDR信号通路突变的患者被分别归为一组。高TMB定义为≥10mt/Mb,低TMB为<10mt/Mb。具体基因突变见图1。 研究结果 患者及治疗特征 研究评估81例接受cCRT和度伐利尤单抗治疗的III期NSCLC患者,95%的患者有吸烟史,中位年龄为67岁,54%患者ECOG评分为0分,69%为腺癌患者,71%的患者为IIIB/C期,31%患者PD-L1表达<1%,25%患者PD-L1表达≥50%。(表1)。患者平均放疗总量60 Gy(2 Gy/日分割放疗),联合铂类化疗。度伐利尤单抗治疗的治疗时间平均为6个月,31%患者因毒副作用停止度伐利尤单抗治疗。
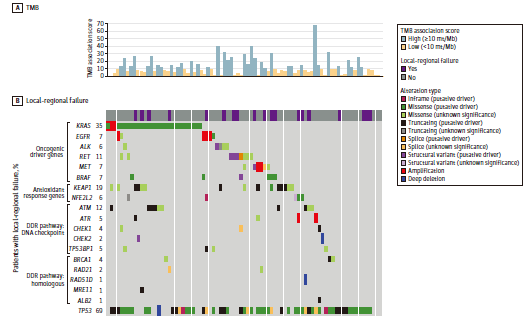
图1. 基因突变图谱
表1. 患者基线特征
基因组特征
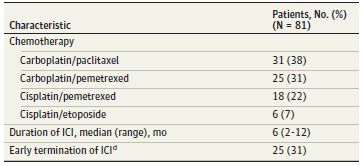
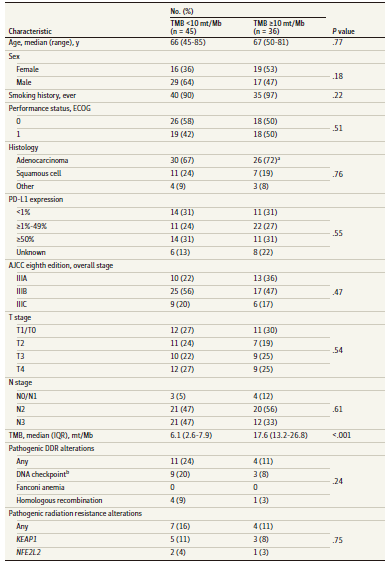
基因组图谱包括特定基因的功能性突变,包括KEAP1/NFE2L2、DDR通路基因和肺癌驱动基因(图1)。14%患者检出KEAP1/NFE2L2突变。19%患者检出一个或多个DDR通路基因突变。7%患者存在以上两类突变。44%患者为高TMB肿瘤,高TMB患者的临床病理学特征与低TMB患者相似(表2)。
表2. 不同TMB患者的基线特征
治疗结局
所有患者的mOS均未达到。mPFS为16个月,12个月和24个月的PFS率分别为61%和45%。23%患者的mLRF为10个月,12个月和24个月LRF率分别为18%和31%。
TMB和基因组突变与LRF的相关性 与低TMB患者相比,高TMB患者的LRF显著降低(图2A)。高/低TMB患者24月累积LRF发生率分别为9%、51%(P = 0.001)。KEAP1/NFE2L2突变患者的LRF风险增加,突变/未突变患者的24月LRF率分别为52%、27%(P = 0.05)(图2B)。DDR突变状态与LRF不相关。 单因素COX风险模型显示,高TMB患者LRF风险降低(HR=0.17, P=0.02)。作为连续变量分析时,高TMB与LRF风险降低显著相关(HR=0.89, P=0.02)。联合TMB与KEAP1/NFE2L2突变状态可鉴别LRF低风险患者。高TMB、无KEAP1/NFE2L2突变患者在24月出现LRF的几率为7%。
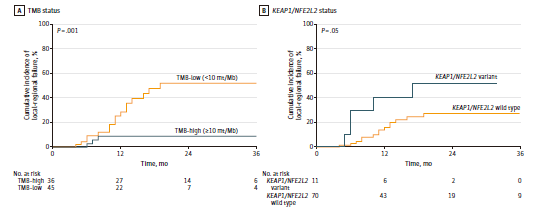
图2. 不同亚组患者的LRF
TMB和基因组突变与PFS的相关性 与低TMB患者相比,高TMB患者PFS延长,高/低TMB患者的24月PFS率分别为66%、27%(HR=0.40, P=0.003,图3)。KEAP1/NFE2L2突变状态与PFS不相关。单因素COX风险模型显示高TMB患者PFS有所改善(HR=0.45, P=0.03),其他因素均与PFS不相关。
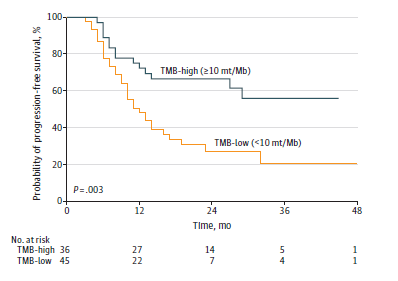
图3. 不同状态TMB患者的PFS
讨论 本研究为针对接受cCRT和度伐利尤单抗治疗的III期NSCLC患者进行前瞻性基因组检测的大规模研究。中位随访时间大于2年,与低TMB患者相比,高TMB患者的LRF风险降低5倍,且高TMB状态与PFS延长显著相关。研究亦发现KEAP1/NFE2L2突变患者LRF风险增加。上述结果为不可切除III期NSCLC患者基于肿瘤基因组学选择个体化治疗方案奠定基础。 尽管有证据表明TMB影响多种治疗模式的应答,但其与NSCLC不同治疗模式预后之间的相关性尚不明确。同样,尽管KEAP1/ NFE2L2通路改突变与放疗及系统治疗耐药相关,但其作为NSCLC独立预后因素的作用亦尚不明确,需进一步验证。 本文发现在cCRT基础上增加度伐利尤单抗巩固治疗可改善预后,但24个月的LRF仍可达31%,提示部分患者需要更加强烈的治疗方式改善预后,低TMB可能是潜在的需强化治疗的人群。31%的患者因毒副作用终止度伐利尤单抗治疗,这使得提前筛选可从免疫巩固治疗中获益的人群显得尤为重要。联合TMB及KEAP1/ NFE2L2突变状态可鉴别出局部治疗失败低危人群。






