近年来,随着早中期肿瘤患者预后管理相关研究的不断深入,肿瘤复发风险及分子残留病灶(MRD)已愈来愈受到临床的关注,正在快速改变着肿瘤诊疗模式。求臻医学倾力打造“臻话MRD”系列文章,为您阐述MRD检测能为临床及患者带来的获益,解析不同技术路径的区别,帮助挑选合适的MRD检测产品。

手术是肿瘤治疗的主要手段之一,尤其是对于早、中期肿瘤,没有发生局部和远处转移,瘤体一般较小,都适宜手术治疗。手术可以直接切除肿瘤组织,减少肿瘤负荷,防止肿瘤继续生长和扩散,甚至达到根治的效果。此外,其他治疗方式也可以为手术提供条件,如术前放化疗可以缩小肿瘤范围,达到降期效果,再行根治性手术治疗。
然而,由于部分肿瘤边界不明显及早期的逃逸,根治性手术后仍可能存在影像学不可见的分子残留病灶(Molecular Residue Disease,MRD),导致复发或远处转移,这是很多肿瘤患者不得不面临的现实问题。

01
肿瘤手术后的复发率如何

早中期肿瘤手术后的复发率与多种因素有关,如肿瘤的类型、分期、分子特征、外科技术、辅助治疗等。随着分期的增加,复发率也会增加。以非小细胞肺癌(NSCLC)为例,在根治性切除后5年内的复发率约为:I期15%-30%,II期30%-50%,III期50%-70%。
表1. 主要实体瘤术后复发率
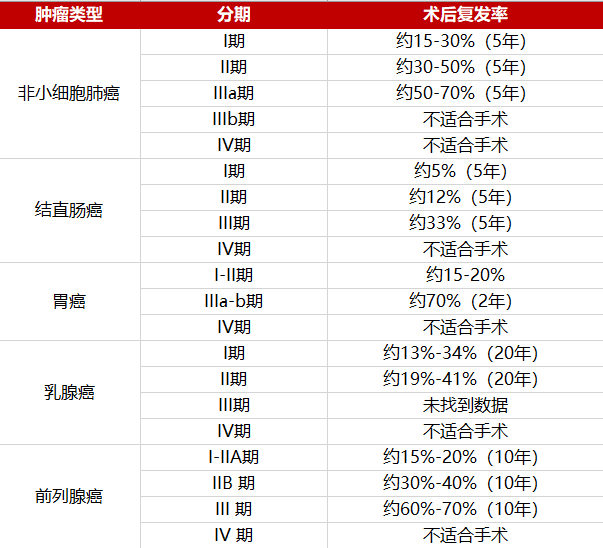
因此,准确预测患者复发风险,并针对性地匹配干预手段,有利于术后患者的治疗选择,降低患者的复发率,改善患者的预后。

02
当前如何预测肿瘤术后的复发风险

目前预测肿瘤术后复发风险的方法主包括以下几类:传统的临床-病理因素、传统的影像学、肿瘤标志物评估和新兴的分子残留病灶检测。
预测肿瘤术后复发风险方法
![]() 临床-病理因素包括年龄、性别、吸烟史、TNM分期、组织学类型、分化程度等,在多数情况下能够反映患者总体预后水平。然而这些因素不能完全区分出高危和低危患者群体,并且不能反映个体差异和微观水平上的状态。
临床-病理因素包括年龄、性别、吸烟史、TNM分期、组织学类型、分化程度等,在多数情况下能够反映患者总体预后水平。然而这些因素不能完全区分出高危和低危患者群体,并且不能反映个体差异和微观水平上的状态。
![]() 传统的影像学(CT、MRI、B超、PET-CT等),可以直观地显示肿瘤的大小、位置和形态,但也有一些局限性,比如不能检测微小的肿瘤灶、不能反映肿瘤的分子特征和异质性等。当影像学可识别到肿瘤复发时,疾病可能已经进展了一段时间,1cm3的肿瘤组织即已包含了107以上的肿瘤细胞。
传统的影像学(CT、MRI、B超、PET-CT等),可以直观地显示肿瘤的大小、位置和形态,但也有一些局限性,比如不能检测微小的肿瘤灶、不能反映肿瘤的分子特征和异质性等。当影像学可识别到肿瘤复发时,疾病可能已经进展了一段时间,1cm3的肿瘤组织即已包含了107以上的肿瘤细胞。
![]() 肿瘤标志物(CEA、CA125、CA153、PSA等)是指一些能反映肿瘤存在和活动的物质,它们存在于肿瘤细胞、血液、尿液或其他体液中,可以通过免疫学、生物学或化学的方法检测到。肿瘤标志物种类繁多,且各个肿瘤标志物与不同癌种关系存在差异。一般来说,没有一种肿瘤标志物是完全特异性的,也就是说,它们可能在正常人或良性疾病中也有升高,也可能在某些恶性肿瘤中没有升高。因此,临床上需要结合其他检查方法和临床表现来综合判断。
肿瘤标志物(CEA、CA125、CA153、PSA等)是指一些能反映肿瘤存在和活动的物质,它们存在于肿瘤细胞、血液、尿液或其他体液中,可以通过免疫学、生物学或化学的方法检测到。肿瘤标志物种类繁多,且各个肿瘤标志物与不同癌种关系存在差异。一般来说,没有一种肿瘤标志物是完全特异性的,也就是说,它们可能在正常人或良性疾病中也有升高,也可能在某些恶性肿瘤中没有升高。因此,临床上需要结合其他检查方法和临床表现来综合判断。
![]() MRD检测是指检测经过治疗后体内残留的微量或不可见的肿瘤细胞或DNA片段(ctDNA),是反映患者个体化治愈效果和预测复发风险最为敏感、准确、直接、实时、动态、全面且可操作的方法之一。MRD检测可以评估患者预后状态,并对患者进行风险分层,指导术后治疗决策。
MRD检测是指检测经过治疗后体内残留的微量或不可见的肿瘤细胞或DNA片段(ctDNA),是反映患者个体化治愈效果和预测复发风险最为敏感、准确、直接、实时、动态、全面且可操作的方法之一。MRD检测可以评估患者预后状态,并对患者进行风险分层,指导术后治疗决策。

03
MRD检测的临床意义

MRD检测在不同类型和阶段的肿瘤中都有重要临床意义。
MRD最早出现在血液系统恶性肿瘤中,如多发性骨髓瘤(MM)、急性淋巴细胞白血病(ALL)、慢性淋巴细胞白血病(CLL)等,已成为血液肿瘤治疗疗效和预后的重要指标,指导治疗方案的选择和调整,评估移植效果和复发风险,提高治愈率和生存期。
在实体肿瘤中,如非小细胞肺癌、结直肠癌、乳腺癌等,MRD检测同样可以作为围术期治疗效果和复发风险的监测手段,帮助识别高危患者并进行个体化干预,提高术后无进展生存期(PFS)和总生存期(OS)。MRD检测还可以指导患者是否可以进入药物假期,即长期使用某种药物后主动停止一段时间,以减少副作用和耐药性。如MRD阴性,则可以考虑进入药物假期;如MRD阳性,则需要继续用药或更换治疗方案。
如DYNAMIC研究显示,对于II期结肠癌患者,根据MRD的检测结果指导辅助治疗策略,可以在不影响患者总体无复发生存期的前提下,降低接近50%的术后辅助化疗率;IMvigor010回顾性数据分析显示,对于高危肌层浸润性尿路上皮癌患者,MRD阳性患者可以从阿替利珠单抗治疗中获益,疾病复发风险降低了42%,OS延长了41%。当前,多个MRD相关的干预性研究正在进行,如CIRCULATE-US、COBRA、CIRCULATE-Japan、DYNAMIC-III等,这些研究可能会改变现有的临床指南和治疗格局。
此外,MRD检测还可以作为新药开发和临床试验的有效工具,评价新药或新方案的安全性和有效性,或作为入组标志物,筛选获益人群,加速药物上市进程。

04
当前MRD检测的主要技术手段一览

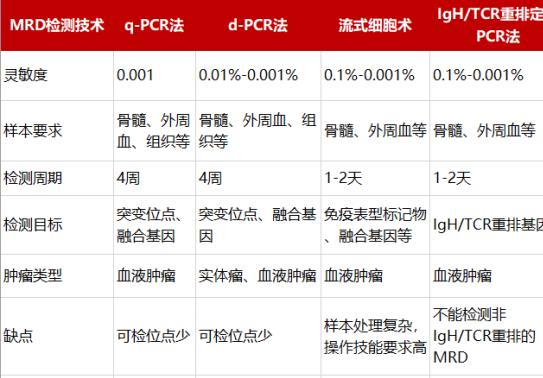
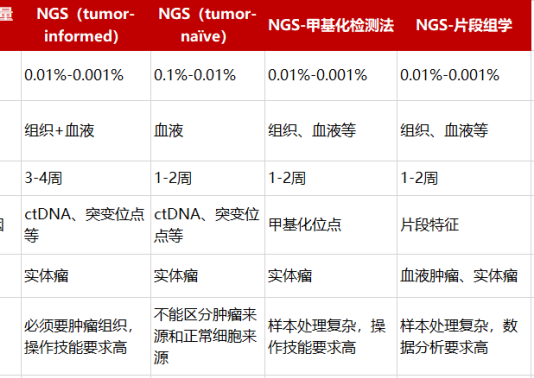
MRD检测的方法根据不同的癌种和样本类型有所差异,但一般可以分为以下几种:流式细胞术(FC)、定量PCR(qPCR)、数字PCR(dPCR)、二代测序(NGS)等。
其中,流式细胞术通过检测细胞表面是否存在某些蛋白质标记物来评估某个细胞是否为肿瘤细胞。这种方法需要新鲜的骨髓抽吸样本或血液样本,并使用特殊的抗体处理,流程复杂,难以标准化。同时,该技术识别具有完整细胞结构的肿瘤细胞,天然适用于血液肿瘤。
qPCR或dPCR可以基于肿瘤热点突变或定制化位点来识别恶性肿瘤细胞的ctDNA,但其一次可检测位点少,在实体瘤中如要检测多个位点可能受到样本量的限制。
NGS可以快速、高通量地检测ctDNA中的各类标志物,包括肿瘤知情分析(Tumor informed assays)、肿瘤不知情分析(Tumor agnostic assays或Tumor naived assays)、甲基化检测以及片段组学检测等。
![]() 肿瘤知情分析和肿瘤不知情分析一般以位点变异为主,前者需要组织结果作为参考或定制panel,后者仅需分析血浆ctDNA的变异情况。
肿瘤知情分析和肿瘤不知情分析一般以位点变异为主,前者需要组织结果作为参考或定制panel,后者仅需分析血浆ctDNA的变异情况。
![]() 甲基化在肿瘤发生早期已有显著变异、变异位点数目丰富,这些表观基因组“标记”在不同患者之间甚至在不同癌症之间更相似,使其成为新MRD检测方法的可能。
甲基化在肿瘤发生早期已有显著变异、变异位点数目丰富,这些表观基因组“标记”在不同患者之间甚至在不同癌症之间更相似,使其成为新MRD检测方法的可能。
![]() 片段组学检测是基于肿瘤患者与健康人血浆中游离DNA长片段的分布差异,片段末端的基序特征以及染色体不稳定性,分析肿瘤的风险。片段组学检测通常基于低深度全基因组测序(low-pass whole genome sequencing,low pass WGS)技术,正在开展肿瘤复发和肿瘤早筛的临床研究。
片段组学检测是基于肿瘤患者与健康人血浆中游离DNA长片段的分布差异,片段末端的基序特征以及染色体不稳定性,分析肿瘤的风险。片段组学检测通常基于低深度全基因组测序(low-pass whole genome sequencing,low pass WGS)技术,正在开展肿瘤复发和肿瘤早筛的临床研究。
表2. 主要的肿瘤MRD检测技术特点
左右滑动查看更多
近年来,得益于高通量测序成本的显著降低、分析算法的不断优化,基于NGS技术的MRD检测技术或产品一经问世,便得到了肿瘤临床的广泛青睐。当前主要应用的是Tumor informed assays和Tumor agnostic assays策略,其中前者还可细分为基于WES+定制化和固定化panel策略,它们均存在各自的优缺点。那么这些技术路径到底有什么区别,临床上又如何选择合适的MRD检测产品,敬请关注下回分节—MRD技术路线之争。

ChosenPace®MRD动态监测方案
定制化+固定化&AI双驱动策略
求臻医学自主研发,创造性地打造了ChosenPace®MRD动态监测方案,基于患者肿瘤组织的1123个基因突变情况(基线),筛选定制化panel(Informed策略),结合肿瘤高发变异的MRD panel(Agnostic策略),实现AI双驱动策略下的超高深度测序。同时,通过深度学习神经网络对十万人大数据背噪库及克隆性造血数据库训练,实现九重联合置信分析,并定期追踪ctDNA状态,进行MRD的动态监测。
ChosenPace®MRD的基线组织检测在分析DNA水平的同时,还涵盖常见融合基因的RNA表达情况及相关肿瘤的HRD状态,综合评估TMB、MSI、HLA分型等免疫治疗标志物及上百个免疫治疗正负向基因,提供全面准确的个体化诊疗信息,构建了肿瘤“筛、诊、治、监、预后”的完美闭环。