臻知识·专家访谈 | 第40期

ctDNA液体活检作为一种无创的检测方法,其在克服样本异质性、样本可及性等方面优势明显,在肿瘤中的临床应用非常广泛,但目前关于通过ctDNA早期监测耐药机制并给予治疗干预能否改善患者预后尚不知晓。求臻医学特邀武汉大学人民医院肿瘤中心许斌教授,结合近期发表在Annals of Oncology杂志上的文章进行解读。
许斌教授:携带EGFR敏感突变的NSCLC患者对一/二代EGFR-TKI初始响应率高,但约60%的患者会因获得性EGFR T790M突变而产生耐药,三代EGFR-TKI的出现改变了这类患者的治疗模式。但临床实践中,并非所有患者耐药后都适合再次活检取组织进行检测,且由于空间异质性问题,单一部位取样也无法代表肿瘤突变全貌。基于ctDNA的液体活检有望解决上述问题,但通过ctDNA早期监测耐药机制并给予治疗干预能否改善患者预后尚不知晓。今天分享的这篇文章,旨在评估连续血浆样本监测EGFR T790M突变的可行性,并探寻吉非替尼序贯奥希替尼的最佳用药时机。
本研究为一项在初治EGFR突变NSCLC患者中开展的随机、非对照、开放标签、3臂的II期研究,入组患者分为3组:A组:接受奥希替尼治疗直至影像学疾病进展;B组:接受吉非替尼治疗直至出现ctDNA EGFR T790M突变或影像学疾病进展,序贯接受奥希替尼治疗直至影像学进展;C组:接受吉非替尼治疗至影像学疾病进展,序贯接受奥希替尼治疗直至影像学进展。B组和C组分别入组52例和51例患者,其中70%患者为女性,65%为EGFR 19号外显子缺失突变,基线1/3患者存在脑转移。所有分组患者均进行血浆ctDNA T790M的动态监测。主要研究终点为B组18个月时的PFS(PFSR-OSI-18),次要研究重点为缓解率,OS及颅内PFS(BPFS)。
研究结果发现B组中17%患者早于影像学进展检出ctDNA T790M突变,进而更换为奥希替尼治疗,中位分子进展时间为266天。B组PFSR-OSI-18为67.2%,C组为53.5%,两组mPFS分别为22.0个月和20.2个月。B组OS未达到,C组为42.8个月,两组18个月OS率分别为87%和77.3%。两组mBPFS分别为24.4个月、21.4个月。
综上,本研究提示利用ctDNA对T790M状态进行连续监测是可行的,可早于影像学识别出17%的分子进展患者,患者通过提前更换为奥希替尼治疗提高了18个月的PFS率及OS率。这项研究结果从全程管理的角度为奥希替尼在二线及后线应用的转换时机、转换方法提供了新思路。也再次证实了液体活检用于监测肿瘤早期复发的价值和优势。持续监测ctDNA状态不仅可为调整方案提供依据,也可为升级/降级治疗提供证据,辅助患者预后分层。
摘要 APPLE研究为一项在初治EGFR突变非小细胞肺癌(NSCLC)患者中开展的随机、非对照、开放标签、3臂的II期研究,入组患者分为3组:A组:接受奥希替尼治疗直至影像学疾病进展;B组:接受吉非替尼治疗直至出现ctDNA EGFR T790M突变或影像学疾病进展,序贯接受奥希替尼治疗直至影像学进展;C组:接受吉非替尼治疗至影像学疾病进展,序贯接受奥希替尼治疗直至影像学进展。主要研究终点为B组18个月时的PFS(PFSR-OSI-18),次要研究重点为缓解率,OS及颅内PFS(BPFS)。 研究结果发现70%患者为女性,且其中65%为EGFR 19号外显子缺失突变。基线时1/3患者存在脑转移。B组中17%患者早于影像学进展检出ctDNA T790M突变,进而更换为奥希替尼治疗,中位分子进展时间为266天。B组PFSR-OSI-18为67.2%,C组为53.5%,两组mPFS分别为22.0个月和20.2个月。B组OS未达到,C组为42.8个月。两组mBPFS分别为24.4个月、21.4个月。该研究提示利用ctDNA对T790M状态进行连续监测是可行的,其可早于影像学鉴定出17%的分子进展患者,并通过提前更换为奥希替尼治疗提高了18个月的PFS率及OS率。 研究背景 携带EGFR敏感突变的NSCLC患者对于一/二代EGFR-TKI初始响应率高,但平均治疗9-15月后,60%的患者会出现EGFR T790M突变进而发生获得性耐药。三代EGFR-TKI的出现为这类患者的治疗带来曙光,AURA研究的1期临床试验已证实奥希替尼用于既往经治,经活检样本证实携带T790M突变患者的RR率高达61%,PFS长达9.6个月,而T790M阴性患者获益有限。基于FLAURA 研究的3期临床试验结果,该药目前已应用于一线治疗。 临床实践中,由于肿瘤进展后的位置或大小等因素限制,并非所有患者在一/二代EGFR-TKI耐药后都适合重新穿刺取组织进行检测,明确耐药机制。同时,由于异质性问题,转移灶单一部位取样也不能代表转移灶整体的基因突变谱。因此,早期监测耐药机制并给予治疗干预是否会影响患者预后目前尚不知晓。有研究表明基于ctDNA检测提示的分子进展可能为动态调整治疗决策提供依据。基于此,2015年EORTC肺癌组设计一项非对照临床研究,旨在评估连续血浆样本监测EGFR T790M突变的可行性,以及吉非替尼序贯奥希替尼的最佳用药时机。 研究方法 EORTC-1613-APPLE研究分组及研究终点详见摘要部分。所有分组患者均进行血浆ctDNA T790M的动态监测。 研究结果 2017年11月至2020年2月,B组及C组分别入组来自6个国家的52例及51例患者。患者基线特征见表1。多数患者为女性(分别为75%、65%),中位年龄分别为69岁、61岁,从不吸烟比例分别为71%、59%。分别有64%、65%患者存在EGFR 19外显子缺失突变。约1/3患者存在基线脑转移。B组及C组吉非替尼中位治疗持续时间分别为39.9周、40.3周;奥希替尼中位治疗持续时间分别为36.1周、28.1周(图1)。B组和C组的ORR分别为53.2%、56.8%;mPFS分别为10.7个月、9.8个月。
表1. 患者基线特征
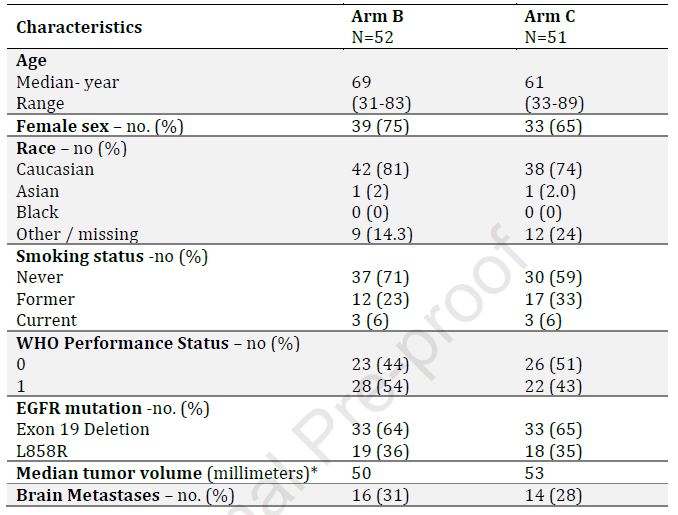
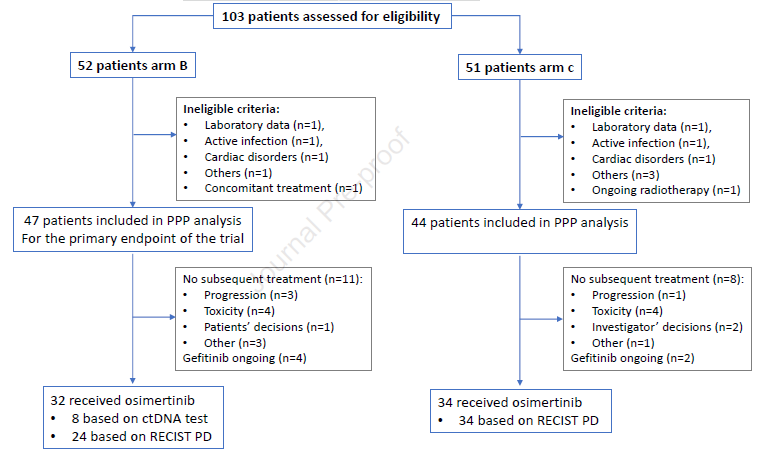
图1. 研究流程
更换为奥希替尼治疗及应答率 68%(32/47)的B组患者更换为奥希替尼治疗,其中8例(17%)患者因ctDNA检测出T790M突变而更换,51%由于影像学进展而更换。在分子进展的患者中,自吉非替尼治疗至出现ctDNA T790M突变平均时间为266天。77%(34/44)的C组患者更换为奥希替尼治疗,8例由于疾病进展/不良反应等原因未能开始奥希替尼治疗(图2)。B组及C组奥希替尼治疗的ORR分别为65.6%、58.8%。B组基于分子进展更换奥希替尼的患者ORR为87.5%,基于影像学进展患者的ORR为58.3%。但在C组中,影像学进展时,7例患者ctDNA检测显示存在T790M突变。
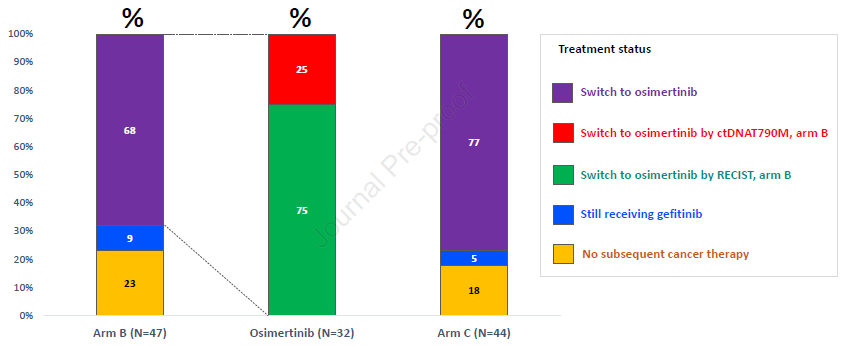
图2. 患者治疗状态
PFS及OS 中位随访时间为30个月,B组患者PFSR-OSI-18为67.2%,意为实验成功(>40%)。其中基于分子进展患者的PFSR-OSI-18为87.5%,基于影像学进展患者的PFSR-OSI-18为62.5%。mPFS分别为22.1个月及21.9个月。C组患者PFSR-OSI-18为53.5%。 另外,对mPFS的探索性分析显示,B组、C组的mPFS分别为22.0个月、20.2个月,HR=0.80(图3A)。亚组分析显示无论EGFR突变类型或基线脑转移状态或其他因素,两组mPFS均无显著差异(图3B)。
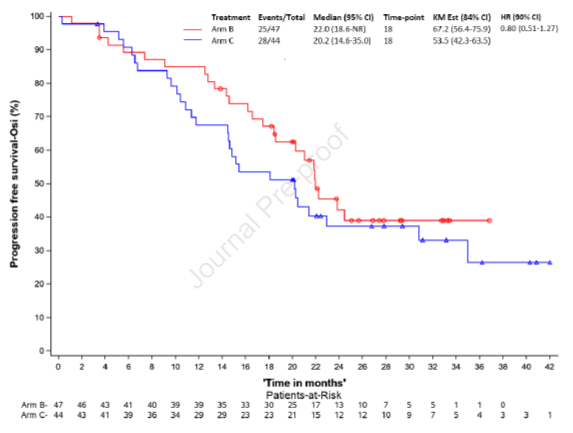
图3A. PFS分析
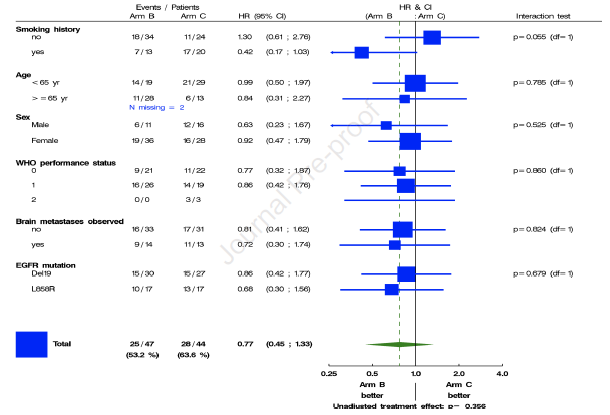
图3B. PFS探索性分析
另外,B组、C组mOS分别为未达到、42.8个月,18个月OS率分别为87%、77.3%(图4)。mBPFS分别为24.4个月、21.4个月(p=0.57),(图5)。
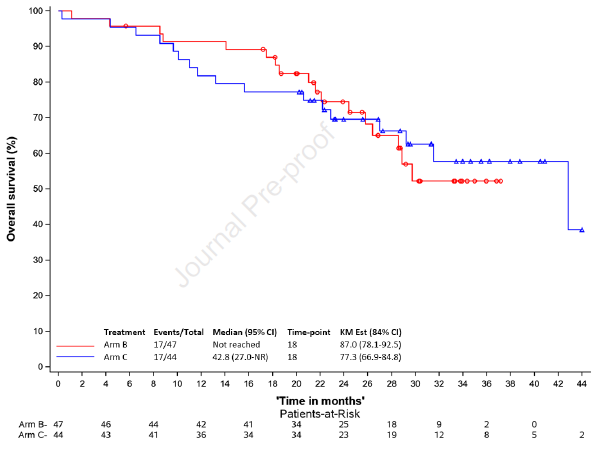
图4. OS分析
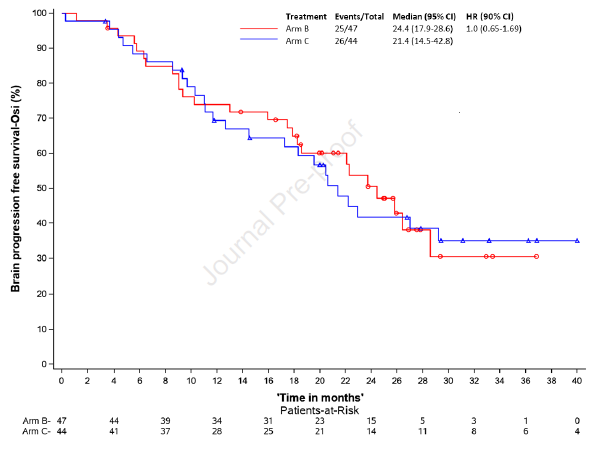
图5. BPFS分析
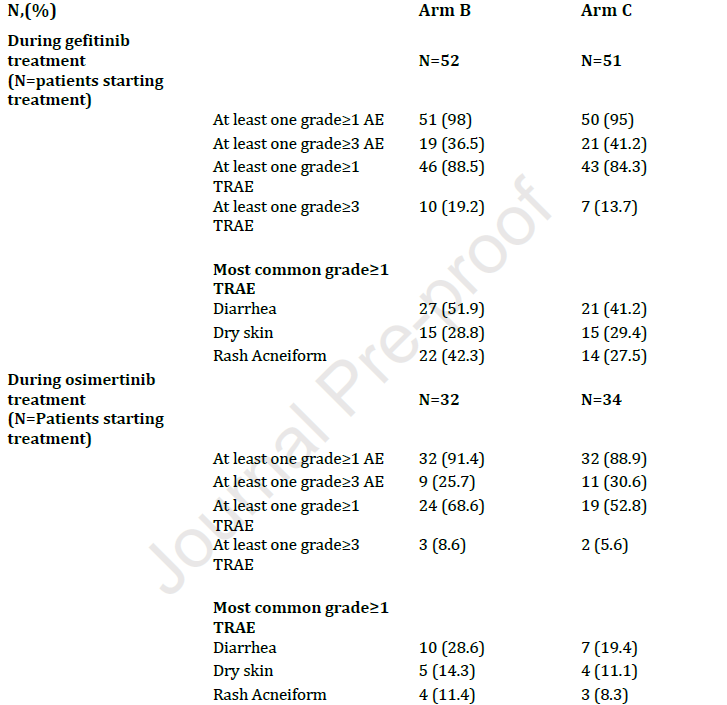
安全性 98%的B组患者出现不良事件,其中88%出现治疗相关不良事件(表2)。
讨论
APPLE研究是首个前瞻性评估NSCLC通过ctDNA持续监测血浆EGFR T790M来指导治疗决策可行性的研究。该研究结果证实通过ctDNA对T790M状态进行连续监测进而指导奥希替尼用药是可行的,该策略鉴定出17%的患者在影像学进展前存在分子进展,在早期调整治疗方案改用奥希替尼后,18个月PFS率增加至87%,优于既往治疗策略(18个月的PFS率低于60%)。与传统影像学评价病情进展相比,分子监测评价疗效可能对患者预后有更加积极的指导作用。
关于晚期EGFR突变的NSCLC中进行EGFR-TKI序贯治疗可能仍存在一些争议。不考虑试验交叉设计的因素,B组及C组生存获益也不逊于FLAURA研究(忽略治疗组)等研究。如,APPLE研究入组患者多为白种人,预后较差,基线1/3患者存在脑转移,而FLAURA研究中这一比例为23%。然而本研究的良好生存获益可能是因为至少70%患者在分子/影像学进展之后换用奥希替尼,其中仅16%的患者影像学PD时在ctDNA检出T790M突变,而在FLAURA研究对照组所有发生进展的患者中,有47%的患者根据T790M检测结果后续接受奥希替尼治疗。这些数据可能表明对于有驱动基因突变的NSCLC,生存获益可能受后续个体化治疗影响较大,而非仅仅由于前期药物延长疾病进展时间。
本研究存在一定不足。本研究在设计时,关于EGFR敏感突变NSCLC患者的治疗格局已发生很大变化,奥希替尼已公认成为优选的一线治疗选择,但本研究更侧重于序贯治疗的方式。其他不足还包括样本量较小、ctDNA监测的灵敏度等等。
总之,APPLE研究表明持续监测ctDNA状态不仅可为调整方案提供依据,也可为升级/降级治疗提供证据,并且可能帮助预测患者预后。但需综合考虑监测ctDNA的经济负担及可及性问题,来判断是否能够使患者获益。






