作为专注肿瘤精准医疗领域的国家高新技术企业,求臻医学拥有一套成熟的线下线上患者招募体系,涵盖了完善的内部管理制度、标准化招募流程,能够快速并准确的筛选符合药企临床实验的目标患者,全程仅需1~2周。目前CLDN18.2阳性的晚期胃癌患者正在招募中。


药物介绍

CT041是科济药业自主研发的、全球第一个获得IND的靶向Claudin18.2(CLDN18.2)的CAR-T细胞候选产品,也是目前全球唯一进入到确证性II期临床试验的用于治疗实体瘤的CAR-T细胞候选产品。CT041已获得美国FDA RMAT认定、欧盟EMA PRIME认定(全球首个获得PRIME认定的实体瘤CAR-T产品),以及美国FDA、欧盟EMA的孤儿药认定。
CT041在2021年ESMO大会公布的研究者发起试验数据表明,在既往接受至少2线治疗失败的18例胃癌患者中,客观缓解率达61.1%,中位无进展生存期达5.6个月,中位总生存期达9.5个月。2022年5月,CT041研究者发起试验的I期期中分析结果在《Nature Medicine》上发表,是首个发表于顶级学术期刊的迄今为止最大样本量的CAR-T细胞治疗实体瘤临床研究。2022年6月,CT041中美注册临床试验数据于ASCO年会首次公布,进一步显示了CT041前景光明的治疗效果及良好的安全性。
科济药业正在中国、美国及加拿大开展 Claudin18.2 CAR-T细胞的临床试验。中国注册临床试验正在全国二十余家中心开展,招募晚期胃/食管胃结合部腺癌受试者。

项目介绍

试验题目:“CT041自体CAR T细胞注射液在晚期胃/食管胃结合部腺癌和胰腺癌受试者中的Ib/II期临床试验”
试验分期:Ib/II期临床试验
适应症:至少二线治疗失败的晚期胃/食管胃结合部腺癌
药物名称:CT041自体CAR T细胞注射液


主要入选标准

1. 自愿参加临床试验;本人完全了解、知情本研究并签署知情同意书;愿意遵循并能完成所有试验程序
2. 年龄18~75周岁,性别不限
3. 经病理确诊的晚期胃/食管胃结合部腺癌患者,且接受至少二线治疗失败
4. 能够提供石蜡包埋的肿瘤组织或可提供不少于6张的白片,经中心实验室检测确定Claudin18.2表达

主要排除标准

1. 妊娠或哺乳期女性
2. 已知患有活动性自身免疫性疾病,或其他需要长期使用免疫抑制疗法疾病
3. 既往接受过任何基因工程修饰T细胞治疗
4. 存在脑转移
5. 受试者出现经研究者判断不适合参加本试验的情况
6. 既往3年内或同时患有其他未治愈的恶性肿瘤
7. 其他严重的可能限制受试者参加此试验的疾病,例如控制不良的糖尿病、控制不佳的高血压、心功能不全等


相关信息

启动时间:2020年10月
组长单位:北京肿瘤医院、复旦大学附属肿瘤医院
主要研究者:沈琳教授、虞先濬教授
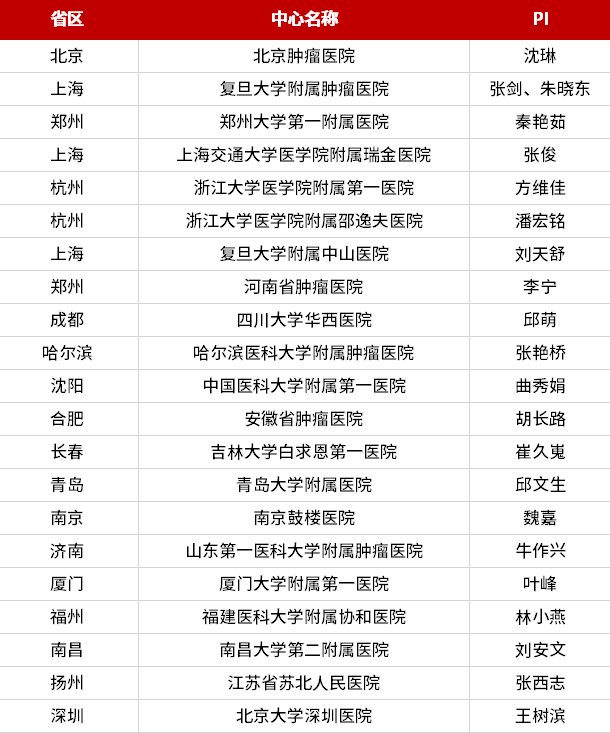
参研中心/开展医院:
* 项目查询:国家食品药品监督管理总局药品审评中心临床试验登记与信息公示平台http://www.chinadrugtrials.org.cn
如您身边有合适的患者意向入组,请联系求臻医学药企合作部:张先生 15011165799
求臻医学药企合作服务
求臻医学专注肿瘤多基因检测,以新一代基因测序和先进信息挖掘技术为基础,为药企提供专业化解决方案。现已与国内外10余家药企就科研/学术合作、临床试验检测、伴随诊断、患者招募、多组学人工智能ChosenMIP大数据服务等展开深入合作,通过将基因检测和人工智能技术深度应用于真实世界研究项目,不断探索发现中国人肿瘤基线及特异的生物标志物,助力抗肿瘤药物的研发,为药企临床前研究、转化医学研究、临床开发和诊断产品开发提供全流程的专业服务。目前,求臻医学构建了遍布全国范围的营销网络,服务于国内500余家顶级医疗机构,为肿瘤患者提供精准诊疗一体化检测服务/为患者提供精准的肿瘤基因检测服务。

患者招募