
乳腺癌是世界上最常见的恶性肿瘤之一,临床专家对于乳腺癌患者药物治疗迭代与治疗策略优化的探索从未止步。本期文章精心挑选了在2024年1月至3月期间,国际知名期刊上发表的5篇关于乳腺癌精准诊疗的最新重磅研究并进行详细解读。希望通过这期的文献分享,能为乳腺癌领域的医师学者提供新的知识和启迪。
本期看点
ASCENT研究:戈沙妥珠单抗(SG)治疗经治转移性三阴性乳腺癌的疗效优于单药化疗
KEYNOTE-522研究探索性分析:早期高危三阴性乳腺癌(TNBC)接受新辅助帕博利珠单抗+化疗后的EFS和RCB相关
BROCADE3公布最终OS数据:维利帕尼治疗gBRCAm/HER2-晚期乳腺癌的PFS改善并没有转化为OS获益
ctDNA动态监测鉴别乳腺癌PARP抑制剂治疗耐药新机制
基于多组学分析揭示乳腺癌新辅助化疗疗效相关的分子特征
ASCENT研究:戈沙妥珠单抗(SG)治疗经治转移性三阴性乳腺癌的疗效优于单药化疗
研究背景
滋养层细胞表面抗原2(Trop-2)在80%~90%的三阴性乳腺癌(TNBC)中过表达,与预后不良、肿瘤生长增加和生存(OS)率降低有关,可作为潜在的治疗靶点。戈沙妥珠单抗(SG)是一种抗Trop-2的抗体偶联药物,是第一个在多个国家获批用于转移性三阴性乳腺癌(mTNBC)患者的ADC药物,其获批离不开III期ASCENT试验的疗效分析结果。本次报告了SG与医生选择的单药化疗(TPC)在意向治疗分析(ITT)人群中的最终疗效和安全性结果以及事后生物标志物分析。
研究方法
在国际多中心III期ASCENT研究中,mTNBC患者被1:1随机分配到戈沙妥珠单抗(SG)组或医生选择的治疗(TPC)组接受治疗,直到出现不可耐受的毒性或疾病进展。主要终点是独立影像学评估(IRC)的基线无脑转移患者的PFS,次要终点包括ITT人群的PFS、总生存期(OS)、客观缓解率(ORR)、缓解持续时间(DOR)、缓解时间和安全性。
研究结果
最终分析结果显示,SG组(n=267)患者的中位无进展生存期(PFS:4.8 v 1.7 m;HR:0.41) 和中位总生存期(OS:11.8 v 6.9m;HR:0.51)较TPC组(n=262)显著提升。在ITT人群中,60%的患者Trop-2染色结果可用,根据Trop-2表达水平将患者分为四组,所有亚组中均观察到SG组的PFS优于TPC组(n=168),OS有改善趋势。
总体而言,戈沙妥珠单抗(SG) 具有可控的安全性,因不良事件导致的治疗相关停药率≤5%,无治疗相关死亡。所有亚组的安全状况一致。

图1. 意向治疗人群的mPFS和mOS
研究结论
这些数据证实针对于多线化疗后的mTNBC,戈沙妥珠单抗(SG) 带来的临床获益优于化疗,表明戈沙妥珠单抗(SG)可作为mTNBC患者二线及后续治疗的新选择。
Aditya Bardia, et al. Final Results From the Randomized Phase III ASCENT Clinical Trial in Metastatic Triple-Negative Breast Cancer and Association of Outcomes by Human Epidermal Growth Factor Receptor 2 and Trophoblast Cell Surface Antigen 2 Expression.J Clin Oncol. 2024 Feb 29:JCO2301409. doi: 10.1200/JCO.23.01409.
KEYNOTE-522探索性分析:早期高危TNBC接受新辅助帕博利珠单抗+化疗后的EFS和RCB分级相关
研究背景
KEYNOTE-522研究表明,新辅助帕博利珠单抗联合化疗可显著改善早期高危三阴性乳腺癌(TNBC)患者的病理学完全缓解率 (pCR)和无事件生存期 (EFS)。先前的研究表明,残余肿瘤负荷(RCB)分级对于量化新辅助化疗后残留疾病的程度具有预后价值。本次探索性分析按治疗组评估了 RCB 分级和EFS的相关性。
研究方法
1174名 T1c/N1-2 或 T2-4/N0-2 期的TNBC患者按2:1随机分配至帕博利珠单抗组或安慰剂组进行9个周期的治疗,直至复发或出现不可耐受的毒性。主要终点是pCR和EFS,使用Cox回归模型评估EFS和RCB分级之间的相关性。
研究结果
与安慰剂相比,帕博利珠单抗治疗组患者有较低的 RCB分级。帕博利珠单抗组中 RCB-0 级(pCR) 的患者较多,RCB-1级、RCB-2级和RCB-3 级的患者较少,患者EFS的HR分别为 0.70、0.92、0.52和 1.24。最常见的首次EFS事件是远处复发,在所有RCB 分级中,帕博利珠单抗组的复发率较低。在RCB-0/1患者中,超过一半 (21/38[55.3%]) 的EFS事件是中枢神经系统复发,其中帕博利珠单抗组为13/22 (59.1%),而安慰剂为 8/16 (50.0%)。

图2. 基于残留癌症负荷(RCB)分级的患者预后
研究结论
在化疗基础上加用帕博利珠单抗可减少RCB-0、RCB-1和RCB-2分级患者的EFS事件,其中RCB-2 分级人群获益最大。研究表明帕博利珠单抗不仅提高了患者的pCR率,而且还改善了大多数非pCR患者的EFS。
L Pusztai, et al.Event-free survival by residual cancer burden with pembrolizumab in early-stage TNBC: exploratory analysis from KEYNOTE-522. Ann Oncol. 2024 Feb 16:S0923-7534(24)00046-2. doi: 10.1016/j.annonc.2024.02.002.
BROCADE3公布最终OS数据:维利帕尼治疗gBRCAm/HER2-晚期乳腺癌的PFS改善并没有转化为OS获益
研究背景
BROCADE3研究表明,针对胚系BRCA1/2突变(gBRCAm)、HER2阴性(HER2-)的晚期乳腺癌患者,在卡铂+紫杉醇双药基础上联合维利帕尼(veliparib)治疗较单纯化疗显著延长无进展生存期(PFS)。本文报告了患者最终总生存率(OS)数据。
研究方法
BROCADE3是一项随机3期临床研究,研究纳入gBRCAm/HER2-的晚期乳腺癌患者,既往化疗线数≤2。患者以2:1的比例随机分配到维利帕尼组和安慰剂组,OS是研究的次要终点。
研究结果
在意向治疗人群(N=509)中,337名患者被随机分配到维利帕尼组接受治疗,172名患者被分配到安慰剂组接受治疗。两组患者的中位OS分别为32.4个月和28.2个月(HR:0.916;P:0.434)。维利帕尼的最新安全性数据与初步分析报告的数据一致,化疗方案中添加维利帕尼耐受性良好。

图3. 意向治疗人群的OS数据
研究结论
先前分析观察到的PFS改善并没有转化为OS获益。两组患者的长期生存数据表明,紫杉醇和卡铂的联合治疗可为BRCA1/2突变的转移性乳腺癌患者带来临床获益。
Véronique Diéras, et al. Veliparib with carboplatin and paclitaxel in BRCA-mutated advanced breast cancer (BROCADE3): Final overall survival results from a randomized phase 3 trial.Eur J Cancer. 2024 Mar:200:113580. doi: 10.1016/j.ejca.2024.113580.
ctDNA动态监测揭示乳腺癌PARP抑制剂治疗耐药新机制
研究背景
靶向同源重组缺陷(HRD)治疗的耐药性限制了PARP抑制剂在乳腺癌患者中的总体有效性。目前多种经过临床前验证的耐药机制已经被提出,但其在临床实践中的发生频率及应对耐药的治疗方案尚不明确。
研究方法
纳入47例携带HRR基因突变(BRCA1、BRCA2或PALB2)、接受PARP抑制剂治疗后发生耐药的转移性乳腺癌患者,其中18例患者属于原发性耐药,29例患者属于继发性耐药。收集患者治疗前、治疗中和进展后多个时间点的血液样本进行循环肿瘤DNA(ctDNA)测序,如果有肿瘤组织样本,对组织样本进行全外显子组和RNA测序,同时评估RAD51的功能状态。
研究结果
60%的耐药患者携带BRCA1/2回复突变,是PARP抑制剂治疗最常见的耐药机制。其中10例患者通过ctDNA检测在临床进展前即发现回复突变。
研究鉴别了两种新的回复突变机制:1)具有内含子断点的基因内BRCA1/2 缺失;2)BRCA1/2 二次突变形成新的剪接受体位点。开启后续治疗前,回复突变的检出与疾病进展时间(TTP)显著缩短相关。回复突变患者保留了HRD突变特征,但是HRD功能状态与RAD51状态相关。尽管没有回复突变发生频率高,非回复突变耐药机制(TP53BP1、RIF1或PAXIP1基因的功能缺失突变)也见于获得性耐药患者中,并且偶尔与回复突变共存。

图4. BRCA1/2 回复突变新机制
研究结论
本研究分析了乳腺癌患者接受PARP抑制剂治疗的耐药机制,这些信息对HRD阳性乳腺癌的临床管理和试验设计具有启示意义。
E Harvey-Jones, et al.Longitudinal profiling identifies co-occurring BRCA1/2 reversions, TP53BP1, RIF1 and PAXIP1 mutations in PARP inhibitor resistant advanced breast cancer.Ann Oncol. 2024 Jan 19:S0923-7534(24)00010-3. doi: 10.1016/j.annonc.2024.01.003.
基于多组学分析揭示乳腺癌新辅助化疗疗效相关的分子特征
研究背景
新辅助化疗已成为乳腺癌的标准治疗策略,但乳腺癌具有高度异质性,尚不清楚哪类患者群体最有可能受益于新辅助治疗。多组学检测可发现乳腺癌患者新辅助化疗前后的基因组和转录组变化,识别与新辅助化疗敏感性相关的分子特征。
研究方法
本研究对50名乳腺癌患者新辅助治疗前后的233个样本进行全外显子组和RNA测序,分析新辅助化疗前后乳腺癌基因组和转录组图谱,并将筛选到的新辅助疗效相关分子特征分别在内/外部验证队列和体外实验中进行了验证。
研究结果
新辅助化疗前后最常见的突变基因是TP53、TTN和MUC16。与治疗前相比,治疗后C>A颠换突变显著减少(P=0.020)。新辅助化疗显著降低了DNA修复信号通路的突变率(P=0.006)和该通路中的基因表达水平(FDR=0.007)。新辅助化疗还显著改变了免疫检查点基因的表达水平以及肿瘤浸润免疫细胞和间质细胞的组成(B细胞、活化的树突状细胞、γδT细胞、M2巨噬细胞和内皮细胞)。
此外,新辅助治疗无应答患者中的C>T转化发生率高于有应答患者。最重要的是在新辅助化疗无应答和有应答患者中,分别在8p11.23处有一个独特的扩增区(包含ADGRA2和ADRB3基因),3p13处有一个独特的缺失区(包含FOXP1基因)。
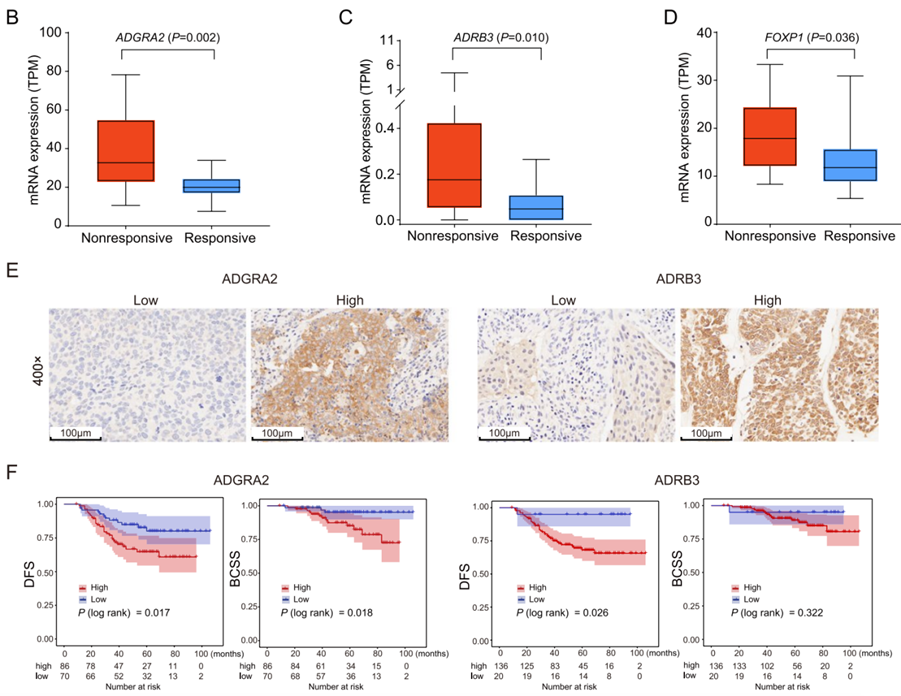
图5. 乳腺癌新辅助治疗的预后相关基因
研究结论
本研究揭示了乳腺癌患者新辅助化疗前后的基因组和转录组特征变化,并确定了潜在化疗耐药和不良预后的新生物标志物(CDKAL1P409L、ADGRA2 和 ADRB3),有助于指导乳腺癌个性化治疗的发展。
Gengshen Yin, Liyuan Liu, et al.Genomic and transcriptomic analysis of breast cancer identifes novel signatures associated with response to neoadjuvant chemotherapy.Genome Med. 2024 Jan 12;16(1):11. doi: 10.1186/s13073-024-01286-8.
获取下方资料请关注公众号并后台回复:臻知速递03期







