摘要
由BRCA1/2导致DNA损伤修复缺陷(DDR)的胰腺导管腺癌(PDCA)亚型预后良好,且对铂基化疗及PARP抑制剂如奥拉帕利治疗均敏感。10%-20%的PDCA患者存在BRCA胚系突变以外的DDR胚系突变(DDR-GAs),此类人群被称为BRCAness表型。本研究纳入2项临床研究,旨在研究奥拉帕利后线作用于PDCA BRCAness表型人群的疗效。 BRCAness表型定义为已被证实携带DDR胚系突变(DDR-GAs)、有BRCA相关肿瘤个人或家族史(无DDR-GAs),或通过免疫组织化学测定的ATM蛋白缺失的PADC。结果发现PDAC中BRCAness表型的定义可能仅限于DDR-GAs人群。携带DDR-GAs(5.7个月,P=0.008)和铂敏感(4.1,P=0.01)的PADC患者接受奥拉帕利治疗后PFS显著延长,DDR-GAs组患者中位OS有延长趋势,铂敏感较铂耐药患者的OS显著延长(10.5月 vs 5.4月,P=0.03)。 研究背景 近些年,尽管在胰腺导管腺癌(PDAC)中广泛开展分子图谱分析以寻找可治疗的基因靶点或信号通路,但靶向治疗仍收效甚微。这其中有一个突破口即DNA损伤修复(DDR)基因突变,包括BRCA1或BRCA2。这些基因的胚系变异可能导致同源重组修复缺陷;包括乳腺癌、前列腺癌和卵巢癌在内的BRCA相关肿瘤,应用PARP抑制剂及铂基础治疗有效。最近一项研究表明,BRCA突变的PDAC患者接受铂类药物为基础的系统治疗后,应用奥拉帕利进行维持治疗时可改善PFS。 “BRCAness”的定义由Turner提出,用于鉴别可能获益于PARP抑制剂的散发性肿瘤表型。但在PDAC中BRCAness的定义较为模糊。14%-16%的PDAC患者存在DDR胚系突变(DDR-GAs),包括BRCA、ATM、PALB2、CHEK1、FANCA、BARD1、RAND50、ARID1A。迄今为止,PARP抑制剂在携带这些突变的肿瘤中疗效尚未明确。众所周知一些家族聚集性肿瘤综合征具有DDR-GAs的特征,但并非所有家族性肿瘤都能够检测到DDR-GAs。且有研究表明有乳腺癌、卵巢癌或胰腺癌家族史的PDAC),即使不存在胚系BRCA突变,有类似DDR-Gas表型的患者接受铂基治疗后的生存期较散发病例也显著延长。因此,本研究假设BRCAness表型可能具有BRCA相关肿瘤家族史,但应用目前的测序平台无法检测出DDR-GAs改变。鉴定BRCAness表型另外一种方法为检测ATM蛋白的缺失。ATM蛋白缺失在家族性PDAC中可经免疫组化检测,与不良预后相关。 研究方法 研究结果
奥拉帕利中位治疗时间为3.0个月。其中,2例(4%)患者出现PR,分别具有PALB2及体系ATM突变。33例(72%)患者出现SD,其中11例疾病稳定时间超过4个月。
中位PFS为3.7个月(图2)。2项研究的PFS无统计学差异。DDR-GAs组患者的PFS较BRCA相关肿瘤家族史组显著延长(5.7月 vs 4.7月,P=0.008)。铂敏感较铂耐药患者的 PFS显著延长(4.1月 vs 2.2月,P=0.01)。DDR-GAs组患者中ATM位最常见突变(14例),但ATM蛋白缺失患者仅5例,两者PFS并无差异。并且ATM突变患者与野生型患者的PFS仍无差异。
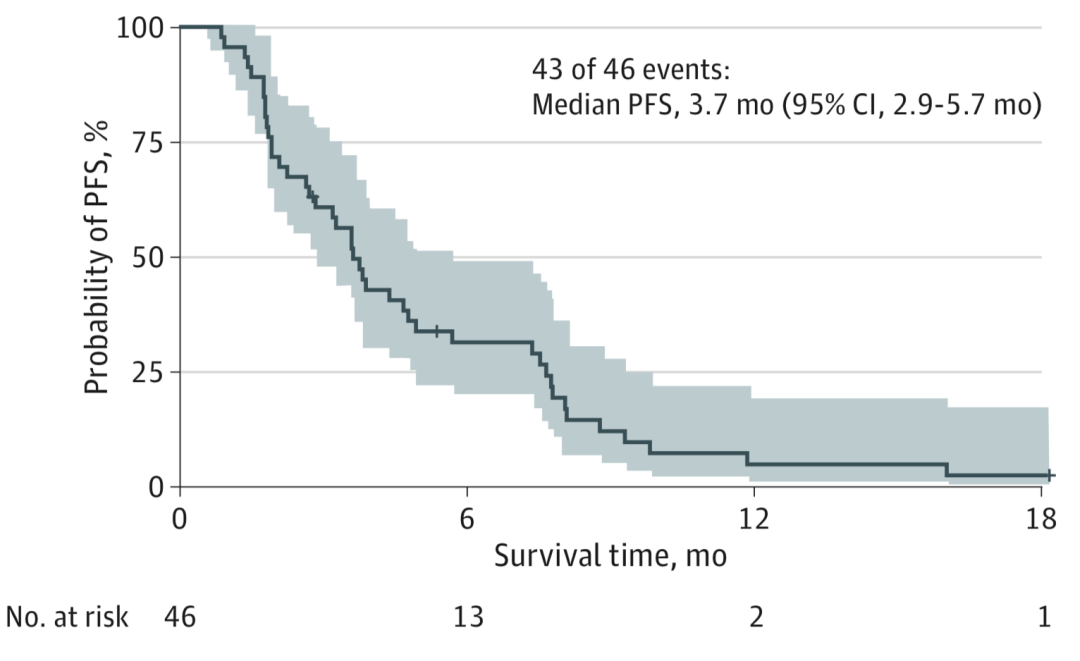
图2. 患者PFS曲线。
中位OS为9.9月(图3)。DDR-GAs组患者中位OS时间较长,但与其他两组无统计学差异。铂敏感较铂耐药患者的OS显著延长(10.5月 vs 5.4月,P=0.03)(图4)。

图3. 患者OS曲线。

图4. 铂敏感、铂耐药患者的OS曲线。
讨论
POLO研究证实奥拉帕利在BRCA突变PDAC患者中的有效性。本研究设想BRCAness表型患者能够从奥拉帕利治疗中获益。研究发现,在平均接受过2种方案治疗的PDAC患者中,奥拉帕利治疗的PFS为3.7月,与二线化疗的数据相当。但仍不及POLO研究中奥拉帕利对BRCA突变患者的疗效。铂敏感及DDR-GAs组患者的PFS及OS明显延长,这与近期应用PARP抑制剂治疗铂敏感卵巢癌的结果一致。
最常见的DDR变异体为ATM基因。在家族性PDAC中存在胚系有害ATM突变,表明ATM是遗传性PDAC的易感基因。2%-18%的PDAC出现ATM体系突变。尽管本研究中未发现ATM突变患者出现PR,但证实疾病稳定普遍存在,且与PFS延长相关。在临床前淋巴瘤及胃癌模型中,ATM蛋白低表达及p53缺失与奥拉帕利敏感性有关。ATM蛋白作为大量下游蛋白的细胞周期检查点激酶调节因子和基因组稳定性DNA损伤的应答因子,发挥着复杂的作用。由于研究纳入样本量小,无法对奥拉帕尼治疗ATM蛋白缺失PDAC患者的疗效进行阐述。
点评 对于本次报道的胰腺导管腺癌(PDCA),ChosenOne599®产品已涵盖包括错配修复通路(MMR)、碱基切除修复(BER)、同源重组修复通路(HRR)等8个通路在内的众多DDR通路基因。此外,ChosenOne599®产品还提供综合了LOH(染色体杂合性缺失)、LST(大片段转换)、TAI(端粒等位基因失衡)三个指标,进行基因组不稳定性评分的HRD检测,可更全面地指导PDCA患者的PARPi治疗,为“癌王”患者提供新的治疗选择及希望。 参考文献: Olaparib monotherapy for previously treated pancreatic cancer with DNA damage repair genetic alterations other than germline BRCA variants. JAMA Oncology. 2021 March 4.






