摘要
研究背景 研究方法 研究结果
利用ddPCR对NGS鉴定出的突变进行动态监测,并对其中野生型和突变型ctDNA拷贝数进行定量检测。结果发现25例存在可利用ddPCR进行动态监测体细胞突变的患者中,只有21例(84%)基线ctDNA检测中存在突变型ctDNA拷贝(图2)。在发现ctDNA阳性的患者中,中位等位基因频率为2.5%。基线时ctDNA和血浆游离DNA(cfcDNA)水平并无关联。基线时ctDNA水平对PFS并无预后指导作用。

图2. 基线时ctDNA检测。患者按ctDNA浓度递减排序。
治疗期间早期ctDNA水平变化及其对生存期的影响
收集治疗后D15和D30的血液样本。D15时,cfcDNA及ctDNA水平均有明显下降(图3a、图3b)。cfcDNA水平下降可能表示哌柏西利对造血细胞的抑制作用。ctDNA下降更为明显(图3c、图3d)。3例患者D15时未检测到ctDNA。D30时cfcDNA中位水平与D15相比无明显变化(图3a、图3c)。从D15到D30,ctDNA水平持续下降,6位患者D30时未检测到ctDNA(图3b、图3d)。
研究中观察到不同患者ctDNA变化的异质性可分为三种模式:1、ctDNA持续降低或为阴性;2、ctDNA水平稳定,但仍能检出;3、ctDNA水平上升。在疾病进展时,所有患者均检测到ctDNA;与D30相比,79%患者存在ctDNA水平上升。
PFS方面,D15的ctDNA水平与PFS无关(图3e)。D30时ctDNA阴性的患者较检出ctDNA患者的PFS延长(25月 vs 3月,p=0.004)(图3f)。

图3. 哌柏西利/氟维司群治疗后早期ctDNA水平变化及对生存期的影响。
a、b:治疗期间4个时间点的cfcDNA或ctDNA水平。黑线为中位值。
c、d:治疗期间4个时间点的cfcDNA或ctDNA的变化。粉色三角为ctDNA较前升高的样本。
e、f:D15、D30时根据ctDNA能否检出得到的PFS曲线。
ctDNA动态变化与疗效的相关性
根据患者治疗后3月的影像学评估,将其分为2组:Non-PD组及PD组。Non-PD患者基线/D15/D30的中位ctDNA水平较PD患者明显降低(图4a)。从D15到D30,83.3%的PD患者ctDNA水平保持上升或不变;89%的non-PD患者ctDNA阴性或持续降低(图4b)。D30时,ctDNA阴性的患者均出现缓解,PD组患者均未出现ctDNA阴性结果。继而根据疾病进展状态进行ctDNA浓度(拷贝数/ml)的探索,发现non-PD患者及PD患者在3个时间点的ctDNA浓度有交叉(基线、D15、D30)(图4a)。表明ctDNA绝对值不能作为预测生物标记物。
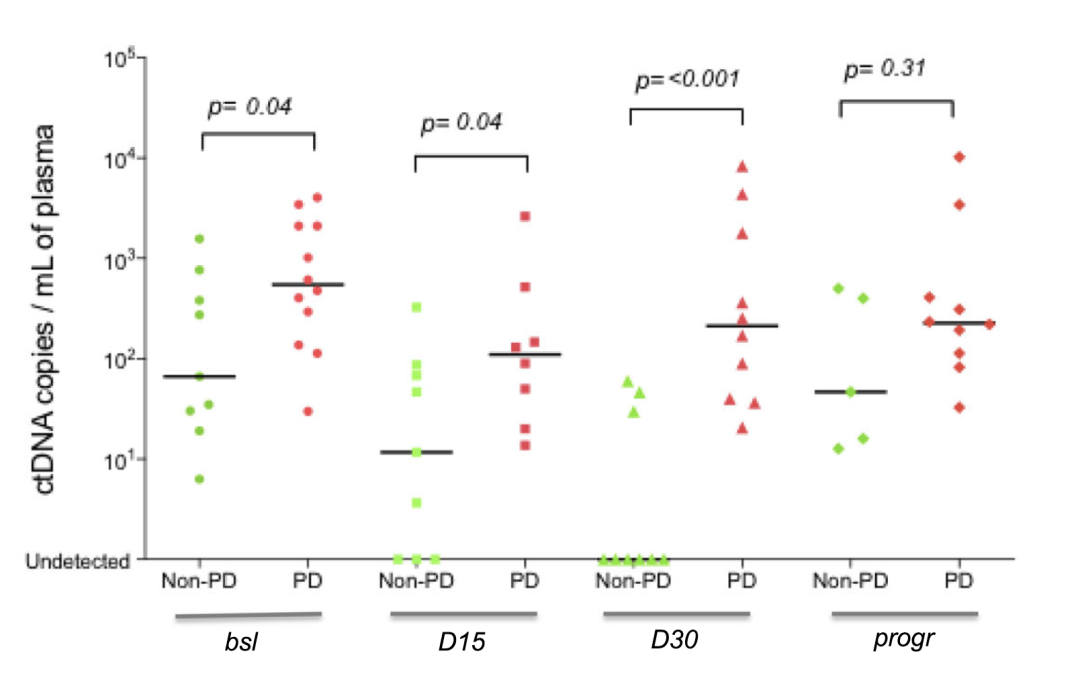
图4. 哌柏西利/氟维司群治疗3月内,Non-PD患者(绿色)与PD患者(红色)治疗期间4个时间点的ctDNA浓度。
ctDNA比值、疗效及对生存期的影响
ctDNA比值表示治疗期间ctDNA水平的变化程度。Non-PD组与PD组D15/基线ctDNA比值均低于1,提示哌柏西利/氟维司群治疗后早期ctDNA水平下降。D15时,两组下降比例无明显差异(图5a)。non-PD组ctDNA水平下降,较PD组降低(D30中位比值= 0 vs 0.9,p<0.001)(图5b)。D30/基线ctDNA比值>1与疾病进展相关(图5b),因此D30/基线ctDNA比值>1强烈预测治疗3个月时疾病进展。研究发现D15的ctDNA比值与PFS不相关(图5c)。但ctDNA比值在D30时高于中位值的PFS更短(图5d)。

图5. ctDNA比值对疗效及对生存期的影响。
a、b:D15及D30时non-PD患者(绿色)及PD患者(红色)的ctDNA比值。
c、d:D15及D30时患者中位ctDNA比值与PFS的关系。
讨论
本研究探索了ctDNA对于接受哌柏西利联合氟维司群治疗早期疗效的预测作用。发现基线ctDNA水平对PFS无预测作用;所有患者D15时ctDNA及cfcDNA水平均有下降。cfcDNA水平下降是哌柏西利治疗后的特点,与既往研究中化疗后cfcDNA变化趋势相反。证实了哌柏西利对肿瘤和造血细胞的抗增殖作用。
通过对ctDNA比值的分析,未发现D15/基线ctDNA比值与PFS的关联。可能由于治疗后ctDNA水平在D15呈显著下降,也可能由于研究样本量较小所致。通过对D30/基线ctDNA比值的研究发现,D15或D30时ctDNA阴性可预测治疗后3个月时的影像学变化。
此外,ctDNA在D15下降的non-PD患者,均在D30时保持ctDNA比例<1。D30时ctDNA水平升高则预示影像学进展。可能由于ctDNA水平与肿瘤负荷相关所导致。
一直以来,对于ctDNA的阈值界定均存在争议。本研究中根据对接受治疗后30天的D30/基线ctDNA比值是否大于1,将患者分为两类。在D15时ctDNA水平均下降的情况下,D30的评估显得尤为重要。19例患者中有11例患者可进行后期影像学评估。其中6例D30时ctDNA阴性的患者治疗3个月后影像学无进展,而ctDNA水平上升的患者出现影像学进展。这一发现可能为25%应用哌柏西利/氟维司群的患者治疗30天后早期更换方案提供依据。但此结果仍需其他研究继续验证。其余8例患者ctDNA水平虽有下降、仍能检出,其对于影像学进展与否并无预测价值。后期需要进行D45、D60甚至更多的时间点检测以区分此类人群ctDNA的预测价值。
点评
本研究证实ctDNA早期变化与患者随后的疾病进展风险密切相关,并且连续ctDNA监测在患者接受如此之强(哌柏西利联合氟维司群)的治疗方案的疗效评估方面具有巨大潜力,可影响临床治疗决策。D30时的ctDNA水平及动态变化是治疗后疾病进展风险的强力预测因素。提示临床阶段,应充分重视此部分患者接受ctDNA动态监测的必要性,进而为乳腺癌患者的全程管理提供有力指导。
ChosenOne599® ctDNA动态监测项目可以一定程度地解决肿瘤异质性难题,获取肿瘤基因变异的全景信息。这些信息一方面可以指导乳腺癌靶向、免疫等个体化治疗,以及包括哌柏西利联合氟维司群在内的多种治疗方式的疗效评估;另一方面还可通过实时动态监测ctDNA的变化,预测乳腺癌的预后,提早发现疾病复发。未来,随着更多标志物及更多临床应用场景研究的发现,ctDNA动态监测在乳腺癌精准诊疗中将占据更重要的地位。
参考文献: Circulating tumor DNA as a dynamic biomarker of response to Palbociclib and fulvestrant in metastatic breast cancer patients. Breast Cancer Research. 2021 Mar 6.






