臻话MSI | 第四期

微卫星不稳定性(Microsatellite instability,MSI)作为重要标志物与多种疾病特征息息相关,其中绝大多数为肿瘤,尤其是子宫内膜癌、结直肠癌、胃癌等。随着NGS等检测技术的发展,MSI在肿瘤中的秘密被逐层揭开。求臻医学推出的“臻话MSI”系列专栏,旨在从多角度介绍MSI及其在肿瘤精准医疗领域的应用,推动肿瘤精准医疗领域的发展。
研究表明,MSI-H/dMMR在子宫内膜癌(28.30%-29.75%)、胃癌(18.71%-21.92%)、结直肠癌(16.61%-19.05%)、肾癌(1.06%-2.15%)、前列腺癌(0.6%-0.65%)、肺腺癌(0.21%-0.63%)等多种肿瘤中均有检出,且发生率大不相同(臻话MSI | 第一期),MSI-H/dMMR在结直肠癌中发生率高,提示MSI在结直肠癌的诊疗中存在相对重要的临床价值。
表1.MSI在不同癌种中的占比

作为实体瘤中备受关注的分子标记物,MSI在结直肠癌(CRC)诊疗中证据最多,应用最为广泛。15%-20%的Ⅱ期和Ⅲ期结直肠癌患者中存在MSI-H/dMMR,与pMMR患者相比有更好的预后;5% mCRC患者存在dMMR,且预后较差;而在遗传性非息肉性结直肠癌(HNPCC),即林奇综合征(Lynch Syndrome)中,超过90%的患者存在MSI。
自本世纪初MSI检测进入结直肠癌临床诊疗后,其在结直肠癌的筛查、治疗选择和预后判断的过程中扮演着日益重要的角色。本期臻话MSI,我们共同了解下,MSI检测在结直肠癌精准诊疗中具体扮演哪些重要角色呢?
1.指导林奇综合征初筛
《遗传性结直肠癌临床诊治和家系管理中国专家共识》(2018)推荐,有条件的医疗单位可对所有CRC患者进行肿瘤组织的4个MMR蛋白免疫组化(IHC)或MSI检测,以进行林奇综合征的初筛。筛查的意义在于对其家属患病的及早发现,及早干预、甚至预防。
2.指导结直肠癌免疫治疗
KEYNOTE-177:2020年美国临床肿瘤学会(ASCO)年会上,LBA研究终于揭开了最后的面纱,其中结直肠癌领域KEYNOTE-177结果也重磅产出,KEYNOTE-177(NCT02563002)是一项III期随机开放标签研究,评估了帕博利珠单抗对比标准治疗(化疗±贝伐珠单抗或西妥昔单抗)一线治疗MSI-H/dMMR的转移性结直肠癌(mCRC)患者的疗效和安全性,取得了阳性结果。帕博利珠单抗组中位随访时间为28.4个月(0.2-48.3),化疗组为27.2 个月(0.8-46.6)。帕博利珠单抗组PFS优于化疗组,中位PFS 16.5 个月 vs 8.2 个月; (HR 0.60; 95%CI,0.45-0.80; P = 0.0002)。

图1. 帕博利珠单抗一线治疗MSI-H/dMMR转移性结直肠癌PFS结果
帕博利珠单抗组12个月和24个月PFS率为55.3%和48.3%,而化疗组为37.3%和18.6%。确认的ORR两组分别为43.8%和33.1%;帕博利珠单抗组未达到中位(范围)缓解持续时间(2.3+至41.4+),而化疗组为10.6 个月(2.8至37.5+)。相对化疗,帕博利珠单抗一线治疗MSI-H/dMMR转移性结直肠癌具有临床意义和统计学意义的PFS改善,且观察到的治疗相关不良事件更少,现在已经成为MSI-H/dMMR的mCRC患者新的治疗标准。
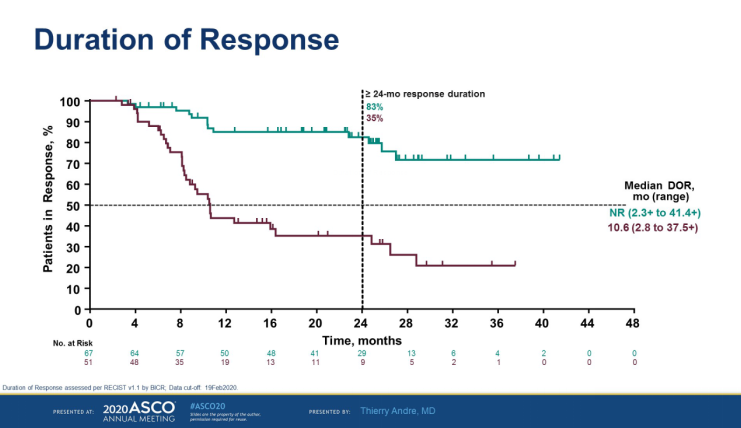
图2. 帕博利珠单抗一线治疗MSI-H/dMMR转移性结直肠癌DOR
3.指导结直肠癌后线免疫治疗
KEYNOTE-016:2015年5月30日,ASCO年会上汇报的KEYNOTE-016研究结果显示,MSI-H/dMMR肠癌队列ORR为40%、MSI-H/pMMR肠癌队列0%。由此可见,晚期dMMR肠癌患者可以从PD-1抑制剂单药治疗中获益,而pMMR肠癌患者无法从抗PD-1治疗中获益。
KEYNOTE-164: 数据证实,帕博利珠单抗在先前治疗过MSI-H/dMMR晚期或转移性CRC的患者中,提供了可管理安全性的持久反应,mPFS为2.3个月(95%CI,2.1到8.1个月)和4.1个月(95%CI,2.1到18.9个月)。mOS为31.4个月(95%CI,21.4个月至未达到)和未达到(95%CI,19.2个月至未达到)。该临床试验提前结束,证实了PD-1单抗对MSI-H / dMMR CRC患者有效性,安全性可控。
KEYNOTE-158:790例患者中有14例MSI-H的患者,且均为tTMB-H。tTMB-H组和非tTMB-H组的ORR分别是29% VS. 6%,排除MSI-H患者后,ORR为28%,提示MSI-H状态不能用来解释tTMB-H患者的更好获益,MSI-H和tTMB可能可以分别作为生物标志物指导免疫治疗的疗效。
表2.KEYNOTE-158研究结果:通过独立中心审查在疗效人群中评估客观反应

体力状态差的后线MSI患者也可以从免疫治疗中获益:有研究报道,从多个中心回顾性方式纳入MSI-H的转移性肿瘤患者,ECOG PS为2或3分,接受抗 PD-1 联合或不联合抗 CTLA -4 的后线治疗:本研究总体客观缓解率为33%,其中6例为部分缓解,3例为完全缓解,中位疗效达到缓解时间为3.1个月,中位疗效缓解持续时间为16.9个月。中位无进展生存为3.4个月(95% CI:2.3-NE),18个月总生存率为50.8%(95% CI:32.7-78.8)。基线变量与生存结局无关。52%的患者在中位时间6周内达到ECOG PS 1,30%的患者在中位时间10周内达到ECOG PS 0。临床实践中可考虑将MSI-H作为终末期PS评分较差肿瘤患者挽救性免疫治疗获益的预测标志物,筛选那些体力评分较差但有较高概率可能从免疫治疗获益的患者接受免疫检查点抑制剂治疗,以获取肿瘤及其带来症状的缓解及更长生存的机会。
4.指导结直肠癌新辅助免疫治疗
NICHE研究:2018年ESMO公布的荷兰NICHE研究是免疫治疗在肠癌新辅助治疗的首个研究。安全性结果显示,所有患者对术前免疫治疗的耐受性很好,纳武利尤单抗+伊匹木单抗新辅助治疗,100% 的dMMR肿瘤明显缓解,而pMMR肿瘤几乎没有缓解。
VOLTAGE研究:2020年ASCO更新了一项来自日本的新辅助免疫治疗VOLTAGE研究结果:研究纳入了MSS患者(N=37)队列A1和MSI-H患者(N=5)队列A2。队列A2的5人中,3人达到了pCR(60%)。截至2020年1月,A1和A2队列中位随访时间分别为22.5个月和6.6个月,MSS患者中2例出现局部复发,2例发生远处转移;MSI-H患者无复发。
5.指导结直肠癌靶向药物疗效
CALGB/SWOG 80405研究:一线FOLFOX联合贝伐珠单抗或西妥昔单抗治疗mCRC,分析显示,MSI-H/dMMR亚组中FOLFOX联合贝伐珠单抗优于联合西妥昔单抗(中位OS期为30个月对11.9个月)。
6.dMMR/MSI-H CRC不能从辅助化疗中获益
多项临床研究表明,dMMR/MSI-H的II期CRC患者不能从5-FU单药辅助化疗获益,对长期生存产生不利影响。中国结直肠癌诊疗规范(2015版)建议有条件者检测组织标本MMR或MSI,如为dMMR或MSI-H,不推荐氟尿嘧啶类药物的单药辅助化疗。

图3.Ⅱ期dMMR/MSI-H患者不能从5-FU辅助治疗中获益
MSI对于结直肠癌的遗传筛查、预后判断和治疗选择上均发挥了重要作用,两部权威指南《NCCN结直肠癌临床实践指南2020 v2》和《CSCO结直肠癌诊疗指南2021版》均推荐所有CRC患者进行MSI检测和(或)MMR蛋白。
求臻医学生信算法开发能力国际领先
求臻医学具备国际顶尖的基因组信息学团队,拥有国际领先的生物信息分析平台及算法,所开发的MACS、MSIsensor、HotSpot3D等算法已在业内应用并广受好评。
求臻医学自主研发的MSIsensor算法被FDA批准的首个基于NGS的肿瘤多基因检测试剂盒(MSK-IMPACT)所采用,同时被近期发布的《结直肠癌分子检测高通量测序中国专家共识》所推荐。
在MSIsensor的基础上,求臻医学多环节引入人工智能技术,持续研发了基于单肿瘤组织和外周血游离DNA(cfDNA)测序数据的MSI状态检测算法MSIsensor2与MSIsensor-ct。截至目前,MSIsensor/MSIsensor2/MSIsensor-ct系列算法已经被超过324篇论文引用,为国际上引用数最高的泛癌种NGS-MSI探测工具集;同时被超过27个国家的670个临床研究项目所应用。

求臻医学MSI检测相关专利及软著(从左到右依次为:一种游离核酸检测微卫星不稳定性的方法及装置、用于检测微卫星不稳定性状态的方法及系统、轻量级组学数据自动化分析软件)






