臻知识·专家访谈 | 第13期

TMB作为泛癌种免疫治疗标志物还需要有更多的临床证据。求臻医学特邀重庆医科大学附属第三医院肿瘤科谢启超教授,结合近期发表在《Cancer Discovery》杂志上的文章进行专业解读。
谢启超教授:近十年来,免疫治疗已经在癌症治疗领域取得了突破性进展。自2011年伊匹木单抗在美国获批上市以来,越来越多的免疫检查点抑制剂(ICIs)已经获批多种癌症的适应症。但遗憾的是,ICIs并非对所有癌种患者都有效,其是否有效的生物标志物研究也还处于比较粗浅的水平。免疫治疗的主要生物标志物包括PD-L1表达、肿瘤突变负荷(TMB)、错配修复缺陷/微卫星高度不稳定状态(dMMR/ MSI-H)和免疫正负向相关基因等。尽管基于KEYNOTE-158研究结果,帕博利珠单抗获批用于TMB≥10mut/Mb的不可切除或转移性实体瘤,但该研究并未纳入结直肠癌及乳腺癌患者。TMB作为泛癌种免疫治疗标志物还需要有更多的临床证据。
近期在《Cancer Discovery》杂志上发表了一篇以TMB作为泛癌种免疫治疗标志物的文章,该研究是基于MyPathway研究中的临床和基因检测数据,入组了32家中心共121例TMB≥10mut/Mb的实体瘤患者,乳腺癌及结直肠癌患者最多。重点比较了TMB≥16mut/Mb的患者和10≤TMB<16mut/Mb的患者接受阿替利珠单抗治疗的预后差异。
42例TMB≥16mut/Mb的患者的中位DOR尚未达到,ORR为38.1%,DCR为61.9%;而10≤TMB<16mut/Mb患者的ORR为2.1%,DCR为22.9%。阿替利珠单抗在TMB≥16mut/Mb患者中的疗效明显优于TMB<16mut/Mb的患者。在已知MSI状态的患者中,发现与MSI-SL(微卫星低度不稳定)患者相比,MSI-H患者的ORR及DCR显著升高,这与既往研究结果相一致。同时POLE/POLD1突变患者与预后的相关性也纳入了研究,结果表明TMB≥16mut/Mb同时POLE/POLD1野生患者的中位PFS显著延长,而无论POLE/POLD1突变与否,TMB≥16mut/Mb患者的ORR及中位PFS均相似。
总之,本研究的结果表明,阿替利珠单抗可作为TMB≥16mut/Mb实体瘤的潜在治疗选择,包括无标准治疗的罕见肿瘤以及原发灶不明肿瘤,为TMB-H的泛癌种患者接受免疫治疗再添新的证据!
摘要
TMB可间接反映肿瘤新生抗原的能力和程度,可以用于预测肿瘤的免疫治疗疗效。本研究通过MyPathway研究中的临床和基因检测数据分析TMB-H肿瘤患者接受阿替利珠单抗的疗效及安全性。纳入分析的121例患者涵盖20种肿瘤类型,其中9种肿瘤对于免疫治疗有应答。42例TMB≥16mut/Mb的患者中,中位DOR尚未达到,ORR为38.1%,DCR为61.9%。其疗效优于10≤TMB<16mut/Mb患者,后者ORR为2.1%,DCR为22.9%。该研究结果提示,无论肿瘤类型如何,TMB均为预测免疫治疗效果的可靠生物标志物。
研究背景
多种肿瘤中发现TMB-H伴随新抗原表达升高,提示肿瘤对于免疫治疗的应答率升高。TMB-H患者约占16.4%(≥10mut/Mb),但不同肿瘤的TMB水平不等。2020年6月,因KEYNOTE-158研究II期篮子试验结果公布,帕博利珠单抗成为首个FDA批准的治疗TMB-H的PD-1抑制剂,并批准FoundationOne CDx成为TMB的伴随诊断产品。其中TMB≥10mut/Mb患者的ORR为29%,TMB<10mut/Mb患者的ORR仅为6%。但该研究只纳入10个瘤种,并不包含发病率比较高的结肠癌及乳腺癌患者。阿替利珠单抗经FDA批准用于尿路上皮癌和非小细胞肺癌(NSCLC)的单药治疗,还有NSCLC、小细胞肺癌、肝癌和黑色素瘤等肿瘤的联合治疗。回顾性研究显示TMB的cutoff值为16时,多种肿瘤应用阿替利珠单抗疗效更佳,但前瞻性数据有限。
研究方法
MyPathway为一项多中心非随机的II期篮子试验,评估目前已有靶向药物在携带潜在治疗基因突变靶点的晚期实体瘤中超适应症治疗的疗效。并评估TMB-H的实体瘤患者接受阿替利珠单抗的疗效及安全性。
研究结果
入组人群
研究入组32家中心共121例TMB≥10mut/Mb的实体瘤患者(图1)。所有患者肿瘤组织均经FoundationOne或FoundationOne CDx检测。与TMB≥16mut/Mb患者相比,TMB介于10和16 mut/Mb之间(10≤TMB<16mut/Mb)的患者中女性患者比例更高,大多经过≥3线治疗,且PD-L1免疫组化评分较低,MSI-H患者比例也较少(表1)。
表1.患者基线特征
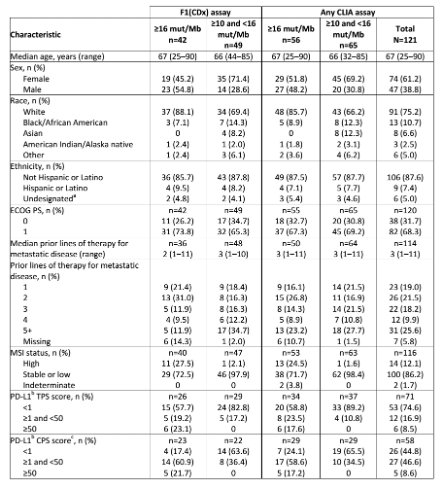

图1.研究流程
F1(CDx) TMB队列患者的临床结局
42例TMB≥16mut/Mb患者中,中位DOR尚未达到。ORR为38.1%,DCR为61.9%(图2A)。其疗效优于10≤TMB<16mut/Mb患者,后者ORR为2.1%,DCR为22.9%(图2B)。两组中位PFS分别为5.7月和1.8月(HR=0.34, p<0.0001))(图3A),中位OS分别为19.8月和11.4月(HR=0.53, p=0.0371))(图3B)。TMB≥16mut/Mb患者的PFS及OS显著延长。


图2. 不同TMB患者的治疗时间。A:TMB≥16mut/Mb;B. 10≤TMB<16mut/Mb


图3. 不同TMB患者的PFS(A)及OS(B)
根据MSI状态分层的临床结局
在已知MSI状态且TMB≥10mut/Mb的86例患者中,11例TMB≥16mut/Mb+MSI-H,29例TMB≥16mut/Mb+MSS/MSI-SL(微卫星低度不稳定)。TMB≥16mut/Mb患者中MSI-H、MSI-SL的ORR分别为54.5%、31.0%;中位PFS分别为8.3月、5.6月;中位OS分别为NE、19.8月。MSI-SL人群中,TMB≥16mut/Mb者的PFS显著优于10≤TMB<16mut/Mb患者(HR=0.33, p<0.0001))。TMB ≥16 mut/Mb的肿瘤中,TPS<1, 1≤TPS<50 和TPS≥50 的患者的ORR分别为 33.3% 、40.0% 和50.0% 。有趣的是所有对于免疫治疗有应答的结直肠癌患者的PD-L1表达水平,无论是TPS还是CPS评分均<50。
POLE/POLD1突变患者的临床结局
对90例患者的探索性分析发现9例患者存在POLE/POLD1突变。ORR为22.2%, POLE/POLD1野生患者ORR为18.5%。42例TMB≥16mut/Mb患者中,携带和不携带POLE/POLD1突变患者的ORR分别为40%和37.8%。10≤TMB<16mut/Mb+ POLE/POLD1野生型患者中位PFS为1.9月,TMB≥16mut/Mb+POLE/POLD1突变患者中位PFS为5.7月( HR= 0.38,p=0.07),TMB≥16mut/Mb+POLE/POLD1野生型患者中位PFS为5.6月(HR= 0.36,p<0.001)。
根据肿瘤类型分层的客观缓解率
MyPathway研究中,TMB≥10mut/Mb共包括19种肿瘤类型(图4A),TMB≥16mut/Mb共包括16种肿瘤类型(图4B)。乳腺癌及结直肠癌患者最多。TMB≥16mut/Mb的结直肠癌患者中, 7/10例患者出现缓解,缓解率为70.0%(表2)。仅有1/7例TMB≥16mut/Mb的乳腺癌患者缓解。值得关注的是,5/7例乳腺癌患者均为激素受体阳性,这部分患者TMB并非是驱动肿瘤进展的主要生物学机制。

图4. 可评估疗效患者的肿瘤类型。A:TMB≥10mut/Mb;B:TMB≥16mut/Mb
安全性
90.9%患者发生治疗引发不良事件(TEAE),3-5级TEAEs发生率为47.9%,严重TEAEs发生率为33.1%。56.2%患者出现治疗相关TEAEs,主要包括乏力、瘙痒、恶心。TEAEs导致19.0%用药中断、5.0%退出研究及4.1%死亡。
讨论
MyPathway研究数据表明阿替利珠单抗治疗多种TMB≥16mut/Mb的晚期实体肿瘤患者疗效较好,且可耐受。本研究招募的患者均接受中位数为3线的治疗,且无更加适合的治疗方法。研究结果显示,阿替利珠单抗在TMB≥16mut/Mb患者中疗效更佳,而在TMB<16mut/Mb患者中疗效有限。
2021年10月,NCCN指南推荐15种肿瘤患者在制定治疗决策前进行TMB状态评估。近期基于大样本的回顾性研究也提示在CD8 T细胞水平与新生抗原存在关联的肿瘤中,TMB≥10mut/Mb是免疫检查点抑制剂应答的唯一预测指标。McGrail等人发现免疫治疗在黑色素瘤、肺癌、膀胱癌中疗效显著,在结直肠癌中疗效有增加的趋势,但对乳腺癌、前列腺癌及胶质瘤却疗效有限。基于KEYNOTE-158研究结果,帕博利珠单抗经FDA加速批准用于TMB≥10mut/Mb的不可切除或转移性实体瘤,但研究并未纳入结直肠癌及乳腺癌患者。MyPathway研究基于肿瘤分子特征纳入患者,与肿瘤位置无关。纳入分析的121例患者涵盖20种肿瘤类型,其中9种肿瘤对于免疫治疗有应答。其中TMB ≥16 mut/Mb的结直肠癌患者应答率较高(7/10),乳腺癌患者应答率则较低(1/7)。结直肠癌及乳腺癌差异巨大的结果与McGrail报道的数据相一致。头颈部肿瘤,胆道系统肿瘤,前列腺癌等多种肿瘤中也可观察到缓解,甚至包括原发灶不明的肿瘤,这为罕见及难治性肿瘤治疗提供新的思路。但仍需前瞻性研究进一步明确其生物学机制。
MSI-H已被证明与多种TMB-H肿瘤相关,包括结直肠癌及子宫内膜癌。本研究发现与MSI-SL患者相比,MSI-H患者的ORR及DCR显著升高,与既往研究结果相一致。且无论MSI状态如何,TMB-H的多种肿瘤均观察到对于免疫治疗有应答,表明MSI-H并非TMB-H肿瘤缓解的唯一驱动因素。因此,再次验证TMB-H是MSI-H结直肠癌接受免疫治疗的独立生物标记物。
POLE/POLD1突变亦应值得关注,POLE/POLD1突变可导致DNA修复缺陷及肿瘤超突变,进而导致对免疫治疗敏感性增加。前期回顾性研究表明免疫检查点抑制剂可提高TMB-H结直肠癌患者的疗效,但TMB状态在接受免疫治疗的POLE/POLD1突变或dMMR患者中无预测价值。本探索性研究显示TMB≥16mut/Mb+POLE/POLD1野生患者的中位PFS显著延长。但无论POLE/POLD1突变与否,TMB≥16mut/Mb患者的ORR及中位PFS均相似。并且7/25例应答者为TMB≥16mut/Mb+MSI-SL+POLE/POLD1野生患者,表明MSI-H及POLE/POLD1突变并不足以解释TMB≥16mut患者的疗效。
本研究对MyPathway的分析结果表明阿替利珠单抗可作为TMB≥16mut/Mb实体瘤的潜在治疗选择,包括无标准治疗的罕见肿瘤以及原发灶不明肿瘤,并且进一步证明靶向PD-1及PD-L1治疗在TMB-H实体瘤中应用的证据。
参考文献:
Atezolizumab Treatment of Tumors With High Tumor Mutational Burden From MyPathway, a Multicenter, Open-label, Phase 2a Multiple Basket Study. Cancer Discov. 2021 Dec 7.