臻话RNA | 第六期

近年来,肿瘤精准医疗飞速发展,尤其是ALK、ROS1、RET、NTRK、FGFR等以结构变异为主的靶向药物陆续上市,越来越多的患者从中获益。目前,基于DNA变异分析为主的精准医疗正在被临床广泛应用,实际上,基于RNA的NGS检测(RNA-NGS)在结构变异检测上展现出更加优越的性能,已被《NCCN 非小细胞肺癌临床实践指南》、《NCCN 结肠癌临床实践指南》、《骨与软组织肿瘤二代测序中国专家共识》等指南及专家共识收录。同时,RNA种类繁多、功能复杂,RNA-NGS应用也更为广泛……在臻话RNA 系列微信文章中,我们陆续介绍了RNA种类,检测方法对比及其在不同领域的应用。本期求小臻将带领大家通过系统地回顾往期精彩内容,对基于RNA-NGS的肿瘤临床实践进行深度剖析。
RNA-NGS检测的优势与不足
根据检测方法不同,RNA-NGS分为全转录组测序和靶向转录组测序。全转录测序(RNA-seq)常用的有poly(A)富集建库和去核糖体建库两种方式。靶向转录组测序主要是基于对目标区域的杂交捕获方法,也常被大家称为RNA-Capseq、RNA panel检测等。
臻话RNA第一期已详细介绍了不同方法之间的对比,每种检测方法都有其适用的场景:poly(A)富集RNA-seq多用于进行基因表达差异、剪接变异分析等,由于对样本质量要求较高,多应用于科研方向;不同于poly(A)富集方法,去核糖体RNA-seq不存在3’端偏好性的问题,而且测序数据中既包含mRNA又包含调控类RNA(lncRNAs,circleRNA等),既可以进行基因表达谱分析又可以进行RNA调控网络分析,在临床实践和科研中均较多应用;RNA panel由于其较高的灵敏性,更适用于临床样本的融合检测。
RNA-NGS在肿瘤精准医疗中的实践
2.1 RNA panel检测显著提高基因融合检出率
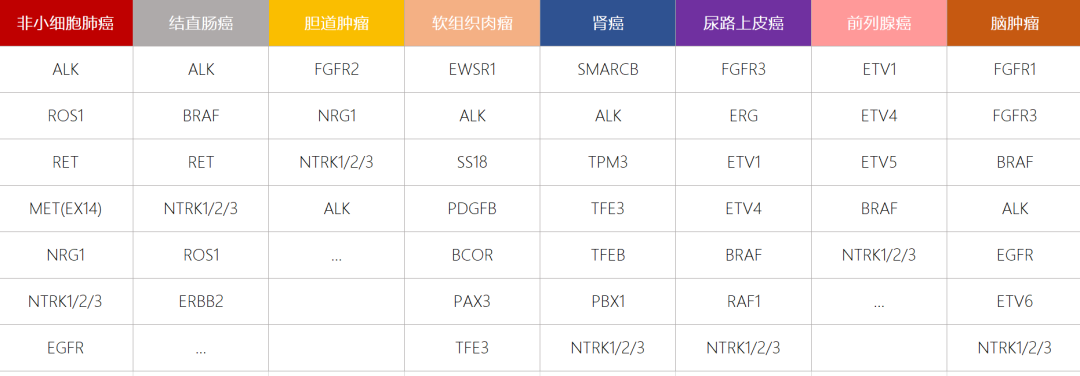
目前,基于RNA panel进行基因融合检测是临床实践中分析RNA最广泛,最成熟的一类应用。一项发表于Cell report期刊,纳入TCGA来源的9624名泛癌种患者(33种癌症)的研究,旨在探究肿瘤中的基因融合。结果显示,16.5% 病例中发生了融合[1]。
表一 ChoseOne 泛癌种基因检测中RNA panel
覆盖各癌种常见融合基因
MET 14外显子跳跃突变(MET ex14)在DNA层面表现出复杂多样的变异形式,包括长度不等的插入缺失、点突变、剪接位点变异等,研究报道有多达500多种突变形式[2],这使得基于DNA检测MET ex14 特别容易发生漏检。NSCLC中,DNA-NGS 对MET ex14变异的检出率为1.3%, 而通过RNA-NGS检测,检出率可提升至4.2%[3]。这表明基于RNA进行MET ex14变异检测,可有效弥补DNA-NGS对复杂结构变异检测能不足的问题,提升检出率。关于RNA与MET ex14更多的故事,已在臻话RNA第三期进行了详细介绍。
除了大家熟悉的ALK、ROS1等基因融合,RNA panel在罕见融合的检出方面也具有非常出色的表现,例如,2021年底发表于Nature的一项针对NSCLC的研究,基于RNA测序发现新的融合CLIP1–LTK,在NSCLC中的发生率约为 0.4%,一名携带该融合的NSCLC患者,接受洛拉替尼100mg每天一次,2个月和5个月随访CT显示,原发灶和转移灶迅速缩小,对洛拉替尼有显著反应[4,5]。更多融合基因在临床中的价值,我们在臻话RNA第二期:RNA—肿瘤融合基因检测利器一文中做了详细的介绍。
尽管基于RNA的检测有诸多优势,但与DNA相比,RNA检测受样本质量影响较大,因此DNA+RNA联合检测,才能更精准、更全面的发现融合基因。

图1 ChoseOne 泛癌种基因检测中RNA panel检测内容
膀胱癌是泌尿系统常见的恶性肿瘤之一,而且呈现逐年上升的趋势。膀胱癌中约90%以上为尿路上皮癌,根据其是否侵犯肌层可分为非肌层浸润性膀胱癌(NMIBC)和肌层浸润性膀胱癌(MIBC)。目前MIBC的治疗方式主要包括:新辅助化疗、根治性膀胱切除术、膀胱部分切除术、术后辅助化疗、辅助免疫、保留膀胱综合治疗等等。
尽管免疫治疗的加入使膀胱癌的治疗选择增加,但是,其诊治仍面临很多困难,例如,膀胱癌的生物异质性导致患者的药物反应性和预后差异显著;对于新辅助化疗疗效不佳的患者,往往进展更快,总生存更差。精准的分型方法将有效改善膀胱癌患者这一现状。中华医学会泌尿外科学分会(CUA)、欧洲泌尿外科学会(EAU)指南也建议临床参考分子分型检测结果,为膀胱癌精准诊疗提供参考。
求臻医学推出的ChosenMaster膀胱癌分子分型检测基于转录组(RNA)的分子分型,参考国际分型方法,对膀胱癌进行精准分型,助力患者预后判断、药物反应性预测,尤其新辅助化疗治疗反应、免疫治疗反应等。

图2 ChosenMaster 膀胱癌分子分型检测内容
以PD-L1表达、TMB、MSI为标志物进行免疫治疗获益人群筛选,已经取得非常突出的成果。然而,这些标志物仍然有不足之处,例如,PD-L1表达阴性患者仍有约10%可从免疫治疗中获益以及总体可受益人群比例低等问题。肿瘤免疫治疗的效果在很大程度上取决于肿瘤微环境,尤其是肿瘤免疫微环境。肿瘤免疫微环境作为最有潜力的生物标志物之一,已受到临床广泛的关注。探索与反应和耐药相关的肿瘤微环境将有助于更精确地识别从免疫治疗中获益的人群。
ChosenMaster肿瘤免疫微环境检测方案,基于RNA测序技术,评估肿瘤免疫微环境状态,预测免疫疗效,为肿瘤免疫治疗临床实践提供参考。

图3 求臻医学ChosenMaster 肿瘤免疫微环境检测内容
RNA-NGS检测未来可期
通过RNA测序进行科学研究由来已久,2019年发表于《Nature Reviews Genetics》的“RNA sequencing: the teenage years”以及2020年发表于《Nature Reviews Cancer》 的“RNA in cancer”[6,7],对RNA 测序技术的发展、不同RNA改变亚型在肿瘤发生发展过程中的作用机制等做了全面、详细的综述。在过去几年中,大量研究揭示了肿瘤中RNA的改变,包括编码RNA加工因子的基因的突变,RNA表达水平的改变以及非编码RNA(lncRNAs,circRNAs, miRNAs等)的改变。
RNA-NGS兼具高通量和出色的结构变异、基因表达检测能力,结合基因组学和蛋白组学,真正实现对肿瘤的全景“解读”,帮助人类对肿瘤的认识提升到新的高度。相信随着RNA测序技术日渐成熟,RNA将完成从科研工具到临床标志物的角色蜕变,而RNA-NGS或可成为肿瘤诊疗的下一个突破点。
往
期
推
荐






