
基于cfDNA/ctDNA检测的液体活检具有微创、可连续取样等临床优势,在临床上应用广泛。在多种实体瘤中均证实其状态与患者的复发风险、疗效预测等密切相关。但cfDNA/ctDNA在肌层浸润性膀胱癌(MIBC)患者中的研究不及肺癌、肠癌等癌种深入,其状态对于MIBC患者的指导价值仍需进一步探索。求臻医学特邀山西省肿瘤医院泌尿外科郝海龙教授,结合近期发表在International Journal of Molecular Sciences杂志上的文章进行解读。
郝海龙教授:我们都知道,cfDNA/ctDNA这一分子标志物在很多实体瘤中都体现出了重要的临床价值,其具有无创、可连续取样、敏感性和特异性较高等优势,为动态监测患者疗效及评估预后提供了可能。但cfDNA水平,片段化特征和ctDNA可否用于MIBC根治术后的疾病监测与复发风险评估目前尚缺乏研究,且并未在临床中形成成熟的应用体系。
本研究探索了cfDNA/ctDNA在MIBC预后判断及病情动态监测中的临床价值,试图回答以上问题。共纳入37例接受根治性膀胱切除术(RC)的MIBC患者,分别于RC术前及术后1、4、12、24个月时采集患者外周血样本进行基因测序与分析。
研究结果显示,术前ctDNA与相应肿瘤组织之间的突变一致性可达65%。ctDNA状态和cfDNA水平与MIBC患者的病理分期相关,pT分期更晚,ctDNA阳性率和cfDNA水平也相应更高。但cfDNA片段化特征在本研究中未体现出与病理分期的相关性。
通过术后不同时间节点的cfDNA/ctDNA的检测结果发现,疾病进展组较疾病未进展组,TERT c.-124C>T的突变频率显著升高,表明TERT c.-124C>T突变可能在肿瘤进展中起关键作用。此外,疾病进展组患者平均cfDNA水平同样显著高于未进展组患者。多变量分析发现RC后四个月的cfDNA水平可作为预测肿瘤进展的独立预测标志物,RC后四个月ctDNA状态为肿瘤特异性生存期(CSS)独立预测标志物。研究还发现,通过与传统影像学对比发现,ctDNA阳性状态可平均早于影像学6个月提示疾病进展。
为了确定cfDNA/ctDNA动态变化在MIBC中的价值,本研究按照术前及术后4个月的cfDNA/ctDNA状态将患者进行分组并分析。结果显示,术后4个月cfDNA/ctDNA阴性患者预后优于术后4个月cfDNA/ctDNA阳性患者,且CSS更长。
本研究中,基线血液样本与肿瘤组织样本具有较高的一致性,ctDNA状态与MIBC病理分期有显著相关性。动态监测结果显示,术后四个月的中位cfDNA水平和ctDNA状态可有效预测患者预后,四个月后ctDNA清除与更好的临床结局相关。这些结果表明在MIBC中应用cfDNA/ctDNA监测疾病进展及判断预后具有良好的前景,未来期待积累更多这方面的数据用于指导MIBC的临床精准治疗。
摘要
cfDNA/ctDNA是近几年兴起的可用于肿瘤诊断、监测及疗效预测的生物标志物。本文通过动态收集MIBC患者不同随访时间节点的血液样本进行cfDNA/ctDNA检测,评估其在MIBC患者预后预测的价值。共入组37例MIBC患者,分别获取行根治性膀胱切除术(RC)前,及术后1、4、12和24个月的血液样本,分析cfDNA含量,片段化特征和ctDNA突变状态,并评估其与临床预后的相关性。平均随访36个月,46%的患者疾病进展,中位至进展时间10个月。RC后四个月的cfDNA水平及ctDNA状态是肿瘤进展(HR=5.290; p=0.033)和肿瘤特异性生存(HR=4.199; p=0.038)的独立预后预测标志物,且术后4个月ctDNA清除率与临床预后显著相关。综上,cfDNA/ctDNA监测有助于预测RC后患者的临床结局并大大改善MIBC患者管理。
研究背景
约25%的膀胱癌(BC)患者初诊时即为MIBC。约40-50%初诊为高级别非肌层浸润性膀胱癌患者最终发展成为MIBC。尽管RC是治疗局限期MIBC的金标准,且部分患者为了降低复发风险接受新辅助/辅助治疗,但临床中仍有约50%患者在RC后两年内发生局部复发或远处转移。
血液中游离的DNA(cfDNA)是用于预测预后及药物疗效的新兴工具,具有微创,可连续取样等优势,目前已在多种实体瘤中被证实具有预后指导价值,但是膀胱癌中尚缺乏研究。本研究旨在探索cfDNA水平,片段化特征和ctDNA可否用于MIBC根治术后的疾病监测与复发风险评估。
研究方法
本研究共纳入2018-2019年收治的37例接受RC的MIBC患者。分别获取患者的手术组织及RC术前、术后1、4、12、24个月时采集外周血样本进行基因检测与分析。
研究结果
患者临床病理学特征
患者的人口统计学及临床病理学特征见表1。中位随访期间为36个月,46%(17/37)的患者疾病进展,中位进展时间为10个月,其中5名患者接受过新辅助/辅助治疗。中位肿瘤特异性生存期(CSS)为16个月。
表1. 患者临床病理学特征
接受膀胱切除术时的组织/血浆突变
组织样本中,ATM、TP53及TERT是最常见的突变基因。值得注意的是,69%患者中发现TERT启动子c.-124C>T热点突变。在16%、42%和13%的组织样本中分别发现TERT c.-146C>T、ATM c.1236-2A>T和TP53 c.853G>A突变。在94%组织样本中检测到上述基因的至少一种突变。
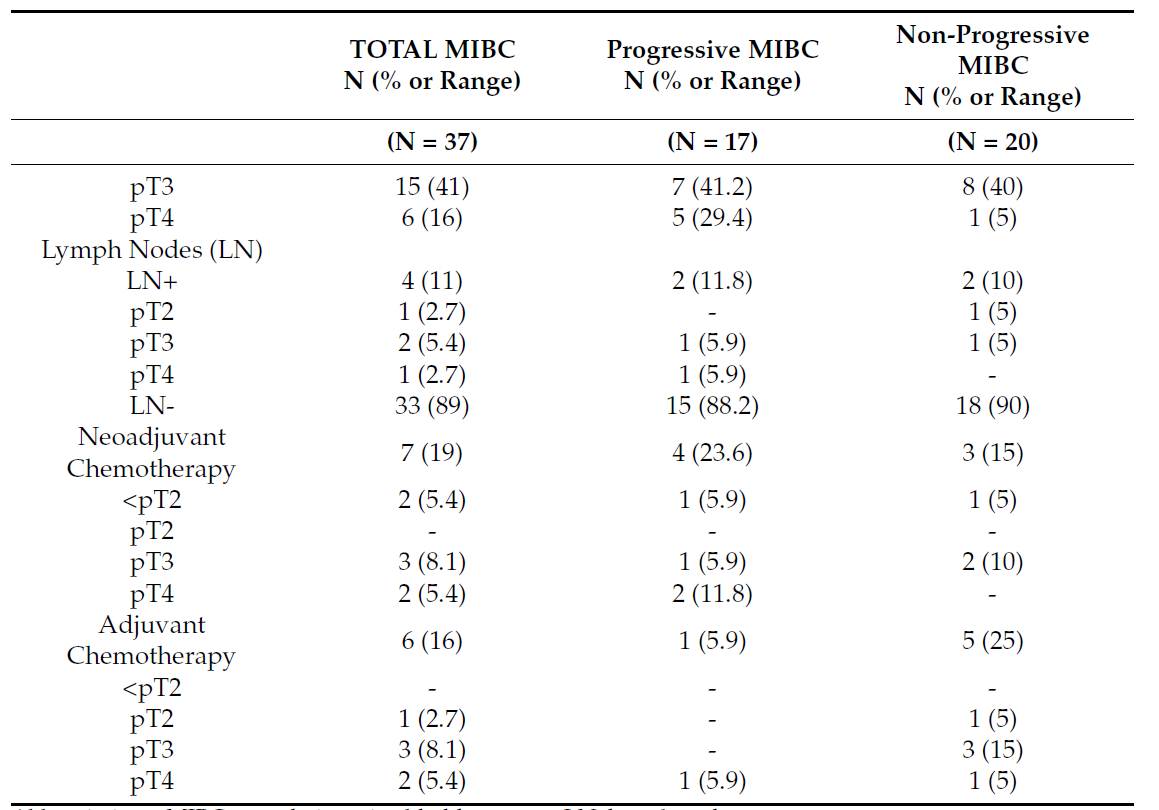
通过分析基线ctDNA中的这四种突变,发现ctDNA与相应肿瘤组织之间的突变一致性达65%。此时,ctDNA状态和cfDNA水平与MIBC患者的病理分期相关;pT分期更晚,ctDNA阳性率和cfDNA水平更高(图1A、B)。然而,cfDNA片段特征与病理分期无显著相关(图1C)。
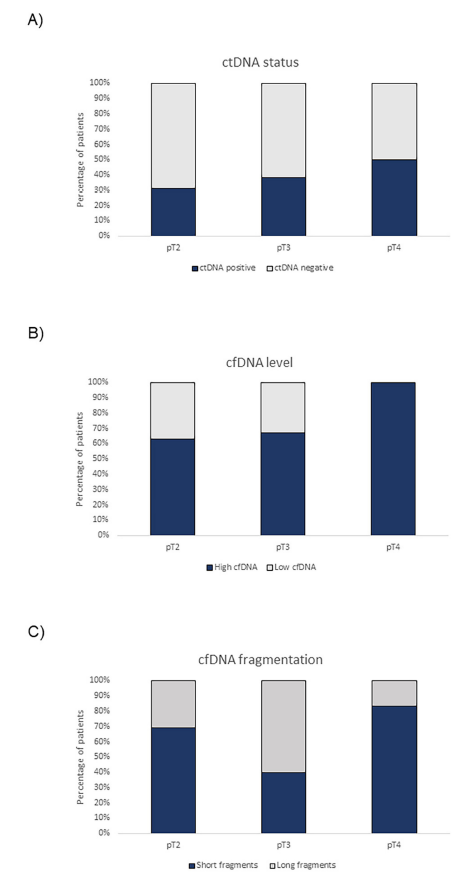
图1. A. ctDNA状态;B. cfDNA水平;C. 基线cfDNA片段化特征
随访期间的ctDNA状态、cfDNA水平、片段化模式
随访期间,TERT c.-124C>T和TP53 c.853G>A的平均等位基因突变频率(MAF)发生显著变化(P值分别为p = 0.03 和 p = 0.011)。平均cfDNA水平也发生显著变化(p = 0.018),在RC后四个月达到最高水平。而平均cfDNA片段化未发现显著改变。
根据疾病状态对患者进行分组,发现与未进展组相比,TERT c.-124C>T的平均MAF在疾病进展组中显著升高。RC后12个月疾病发生进展的患者的平均cfDNA水平显著高于未发生进展的患者(p = 0.045,图2)。
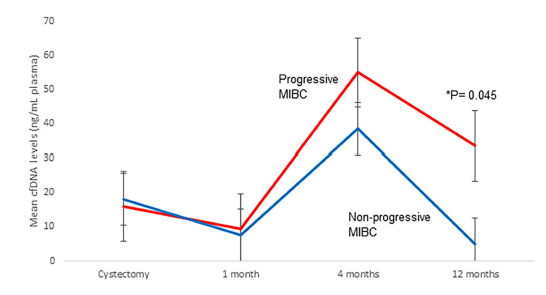
图2. 不同肿瘤进展状态患者的动态cfDNA水平
ctDNA及cfDNA的预后价值
多变量Cox回归分析提示RC后四个月的cfDNA水平为肿瘤进展的独立预后标志物(HR= 5.290; p = 0.033),RC后四个月ctDNA状态为CSS独立预测标志物(HR=4.199; p = 0.038)。根据RC后四个月的中位cfDNA水平(4.1 ng/mL)和ctDNA状态(阳性/阴性)可将患者划分为肿瘤进展组、非进展组或CSS高风险组、CSS低风险组。此外,与影像学相比,ctDNA阳性状态可平均早于影像学6个月提示疾病进展(p=0.024,图4)。
图3. ctDNA状态和cfDNA水平预测预后。A. RC四个月后根据cfDNA水平分层的疾病进展组及疾病非进展组;B. RC四个月后根据ctDNA状态分层的CSS高风险组、CSS低风险组
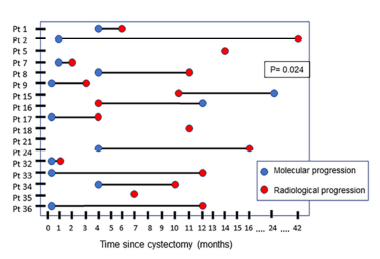
图4. ctDNA状态和影像学评估的临床比较
ctDNA状态及cfDNA水平变化的预后价值
为了确定RC后ctDNA状态和cfDNA含量变化在预后评估方面的价值,将患者分为四组。第1组:所有时间点均为ctDNA为阳性/cfDNA高水平;第2组:基线ctDNA阳性/cfDNA高水平,RC后四个月时ctDNA阴性/cfDNA低水平;第3组:基线ctDNA阴性/cfDNA低水平,RC后四个月时ctDNA阳性/cfDNA高水平;第4组:所有时间点均为ctDNA为阴性/cfDNA低水平。第2组、第4组患者预后优于第1组、第3组(p = 0.033),且CSS更长(p = 0.002,图5)。此外,与第1组相比,第3组预后更差、CSS更短(图5)。RC后四个月的ctDNA清除率与临床结局呈显著相关(p = 0.033)。
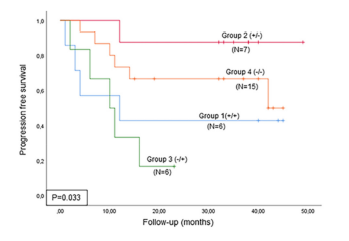
图5. 根据基线及RC后四个月ctDNA/cfDNA状态不同分组患者的无进展生存期曲线
讨论
近年来,液体活检已在肿瘤研究中广泛使用,可用于肿瘤进化的实时评估和管理。在膀胱癌中,已有一些研究证实ctDNA阳性与不良预后相关,但目前ctDNA尚未应用于RC后BC患者的常规随访。
本研究基线血液样本与肿瘤组织样本具有较高的一致性,ctDNA状态与MIBC病理分期相关。RC后4个月及12个月TERT c.-124C>T的平均MAF在疾病进展组患者中显著高于未进展组患者。RC后四个月ctDNA阳性患者发生癌症特异性死亡的风险较高,进一步支持ctDNA在接受RC后MIBC患者随访中的预后价值。患者RC后四个月ctDNA清除与更好的临床结局相关,反之亦然。
本研究首次通过联合四种体细胞突变,连续收集患者血浆样本,动态分析血浆ctDNA状态,cfDNA水平及片段化特征与患者预后的关联。表明在MIBC中应用BC常见基因监测疾病进展存在可行性。






