
臻知识·专家访谈 | 第37期
ctDNA是肿瘤细胞释放到血液中的DNA,能实时反映肿瘤状态,且ctDNA检测具备无创、可多次重复取样的优势,目前已广泛应用于检测微小残留病灶和复发、预后评估、监测耐药等,但ctDNA动态监测是否可在治疗早期预测晚期实体瘤免疫治疗疗效尚无定论。求臻医学特邀海军军医大学第三附属医院生物治疗科仇金荣教授,结合近期发表在Mol Oncol杂志上的文章进行解读。
仇金荣教授:免疫检查点抑制剂可改善肿瘤患者的生存,但是仅有部分患者可长期获益,因此需要生物标志物来筛选免疫治疗优势人群。临床上批准的免疫治疗疗效预测生物标志物有PD-L1高表达、MSI-H、和TMB-H,但以上标志物无法对正在接受免疫治疗的患者进行动态疗效评估,因此迫切需要探寻新的生物标志物。ctDNA检测无创,可多次重复取样, 有望满足对于患者治疗疗效和肿瘤负荷进行动态监测的临床实际需求,是极具潜力的生物标志物。
该研究共纳入112例晚期实体瘤患者,分为未经分子标志物筛查队列和经TMB富集的扩展队列。患者先进行4个周期的度伐利尤单抗和替西木单抗治疗,之后进行度伐利尤单抗单药治疗。免疫治疗前采集组织样本进行基因检测(基线),基线期、第2/3周期开始前采集ctDNA进行个性化检测。48例TMB≥10mut/Mb的患者纳入TMB富集的扩展队列,其中29例患者可在基线时进行ctDNA分析,15例患者可在基线和基线后(至第8周)进行ctDNA动态分析。
免疫治疗4周后,7名患者的ctDNA水平较基线下降,与ctDNA水平升高患者相比,ctDNA水平降低患者的总生存期显著延长,mOS分别为29.2个月和9.4个月。治疗8周后的ctDNA分析结果与该结论一致,mOS分别为29.2和11.5个月。提示早期ctDNA动态变化可预测晚期实体瘤患者双免治疗的长期生存获益。治疗8周内ctDNA水平下降患者的OS皆优于ctDNA升高患者,不论最佳疗效评价结果如何。ctDNA清零患者与8周内ctDNA水平下降患者的OS获益类似,均显著优于ctDNA升高患者。且治疗8周内任何时间点的ctDNA清零可较影像学提前预测肿瘤的完全缓解,中位提前时间为11.5个月。
综上,在接受度伐利尤单抗和替西木单抗治疗的实体瘤患者中,治疗8周内ctDNA水平的下降与长期临床获益相关,提示早期ctDNA水平可预测晚期实体瘤患者免疫治疗的生存结局,可作为影像学评估疗效的有力补充。本研究ctDNA动态监测的策略是根据基线肿瘤组织检测结果进行个性化的跟踪和检测,可使临床医生基于基线组织检测结果选择个体化治疗方案,并利用非侵袭性的采血方式,对ctDNA进行动态检测、可实时监测疗效,提早预测肿瘤进展并为及时调整治疗策略提供重要参考信息,避免不必要的治疗不良反应并减轻患者经济负担。
摘要
目前急需探寻在治疗初期即可预测免疫检查点抑制剂(ICI)获益的生物标志物。本研究通过对接受度伐利尤单抗(durvalumab)和替西木单抗(tremelimumab)治疗前患者的肿瘤组织样本(基线)进行基因检测,设计个性化的ctDNA动态监测策略。在基线以及免疫治疗4周和/或8周时进行ctDNA评估。ctDNA变化与影像学响应和总生存期(OS)之间的相关性被用来评估潜在的临床获益。87.5%(35/40)的患者可设计个性化的ctDNA监测策略,82.9%(29/35)在基线时有血液样本可供分析,研究涉及16个不同的癌种。与基线相比,治疗4周后ctDNA水平下降患者的OS延长(P = 0.0144; HR = 9.98),治疗支持和影像学响应的患者ctDNA发生变化。且治疗8周内任何时间点的ctDNA清零可较影像学提前预测肿瘤的完全缓解,中位提前时间为11.5个月。ctDNA 正在成为实时有效的特异性生物标志物,可以预测不同实体瘤患者免疫治疗的生存结果,补充甚至先于影像学评估预测治疗疗效。
研究背景
度伐利尤单抗和替西木单抗分别为PD-L1单抗和CTLA-4单抗,可联合用于晚期肿瘤治疗。尽管免疫治疗可改善患者生存,但是仅少数患者可长期获益。目前尚无稳健的生物标志物用来预测泛癌种免疫治疗疗效。PD-L1高表达、MSI-H及TMB-H在某些癌种中可用于预测免疫治疗疗效,但患者经过治疗后无法进行动态评估。ctDNA恰好能弥补该临床需求,可纵向评估并实时监测肿瘤负荷变化。此外,ctDNA可预测患者的生存结果,并可用于对患者进行风险分层,确定最有可能从免疫治疗中长期获益的患者。对患者进行ctDNA的动态监测可及早预测肿瘤进展,为临床医生及时调整治疗方案提供依据,避免不必要的治疗不良反应及减轻患者经济负担。
本文通过评估接受度伐利尤单抗和替西木单抗治疗患者的ctDNA动态变化与患者长期生存之间的关系,探寻ctDNA作为双免联合治疗新型疗效预测标志物的潜力。
研究方法
研究设计及入组人群
本研究(MoST研究)为多中心开放II期研究,共入组来自澳大利亚四个医疗中心的112名患者,分为未经分子标志物筛查队列和经TMB富集的扩展队列(TMB≥10mut/Mb)。入组患者皆为经病理学确认的、不愿意接受标准治疗或既往标准治疗失败的晚期实体瘤患者,且之前没有接受过PD-1、PD-L1或CTLA-4抑制剂治疗。治疗初期进行4个周期固定剂量的度伐利尤单抗/替西木单抗(度伐利尤单抗1500mg,替西木单抗75mg,四周一周期)治疗,之后进行最多9周期的度伐利尤单抗治疗。在12个月的治疗结束时实现并保持疾病控制的患者,若后续出现疾病进展,可重启联合治疗;在接受durvalumab单药治疗的第一个12个月治疗期内发生进展性疾病(PD)的患者也可重启联合治疗。
血液采样
对肿瘤组织进行PD-L1表达(SP263抗体)及肿瘤浸润淋巴细胞(TIL)检测。PD-L1阳性/阴性及TIL高/低的阈值皆为1%。分别在基线期、第2/3疗程开始前进行ctDNA采样,并用组织知情的个性化ctDNA检测方法进行检测。
研究结果
泛肿瘤队列中基于组织的个体化ctDNA检测
本研究纳入2018年11月至2019年11月期间的48例患者进入扩展队列,患者TMB均≥10mut/Mb。本队列患者的中位无进展生存期(PFS)为2.9个月,中位总生存期(OS)为11.9个月,客观缓解率(ORR)为14%。48例患者中有40例患者符合ctDNA分析标准,其中87.5%(35例)的患者基线组织检出≥2个可进行动态跟踪的体细胞突变,29例患者可进行治疗前血液样本的ctDNA分析,肿瘤组织样本和治疗前血(基线血)样本采集时间间隔中位时间为404天(图1)。29例患者分为四个主要的疾病治疗组:结直肠癌(n=10)、肉瘤(n=9)、混合实体瘤(n=8)及胶质瘤(n=2),对应16种不同的组织学类型。中位PFS为1.8个月,中位OS为20.1个月。
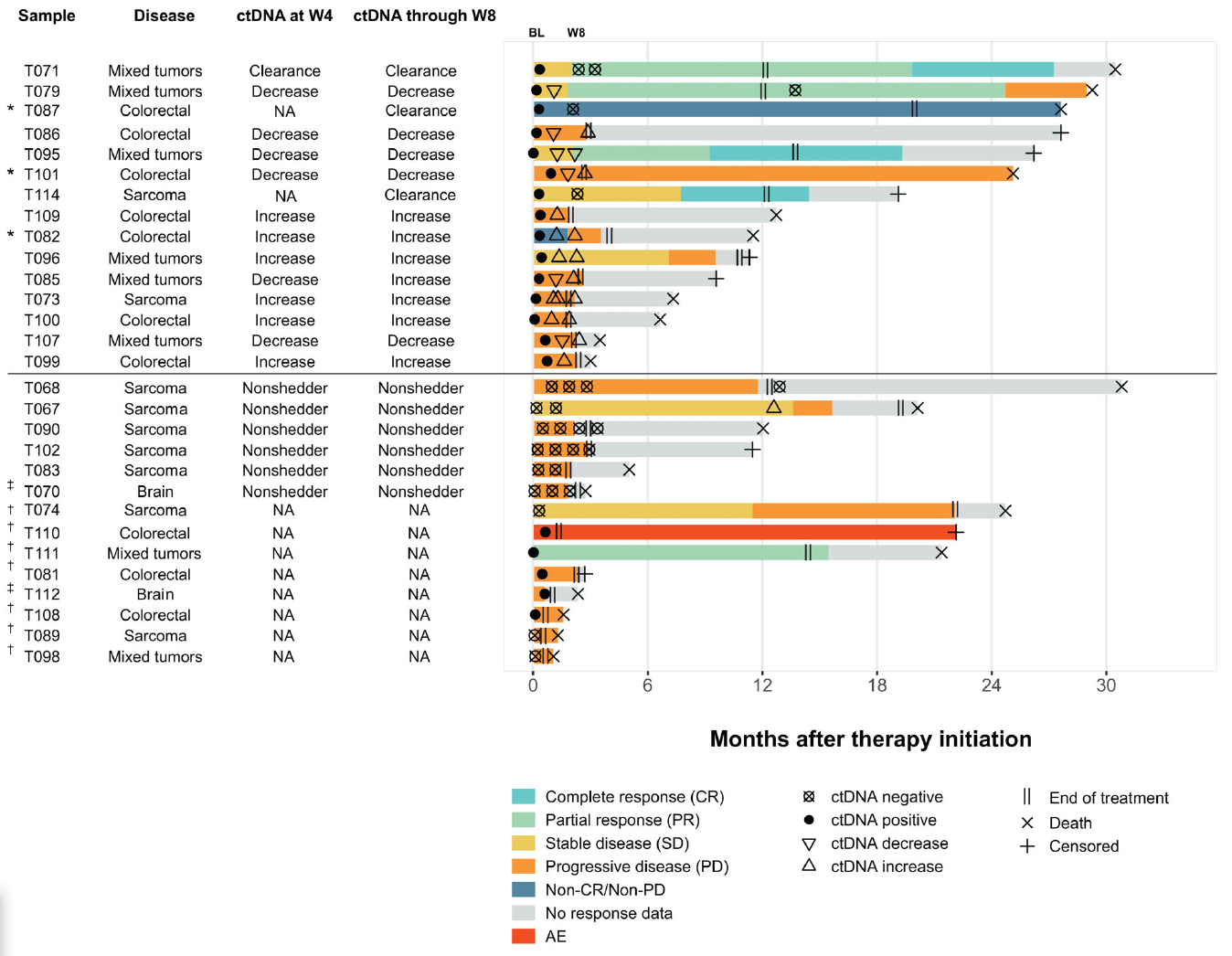
图1. ctDNA状态、ctDNA自基线水平的变化及临床应答
早期ctDNA水平变化可预测患者长期生存
通过对29例患者基线期组织和血液进行基因检测,不同疾病组具有不同基因突变谱,仅TP53突变是在不同疾病组均有检出的复发性致癌突变(整体检出率65.5%,图2)。检测到的临床相关突变在个体基础上有所不同,与队列的多样性一致。
15例患者在基线和基线后(至第8周)均可进行ctDNA动态分析。其中13例(87%)患者最早在度伐利尤单抗/替西木单抗治疗开始后4周(完成1周期双药治疗)就可进行ctDNA分析。第4周时, 7名(54%)患者的ctDNA水平较基线下降,与ctDNA水平升高患者相比,ctDNA水平降低患者的总生存期显著延长(mOS : 29.2 vs 9.4个月, P=0.0144, HR=9.98 ; 图2)。治疗8周后的ctDNA分析结果与该结论一致(mOS : 29.2 vs 11.5个月, P=0.0105, HR=11.6),提示早期ctDNA评估可用于疗效预测。
通过对所有有基线ctDNA检测结果的队列进行单因素分析发现治疗后4周或8周内的ctDNA水平下降是生存获益的唯一、重要的基因组生物标志物(图2C),其它已知的免疫治疗疗效预测标志物如MSI-H、高TMB及PD-L1表达水平均与生存获益无显著相关性。因此,早期ctDNA动态变化可预测晚期实体瘤患者双免疫治疗的长期生存获益。
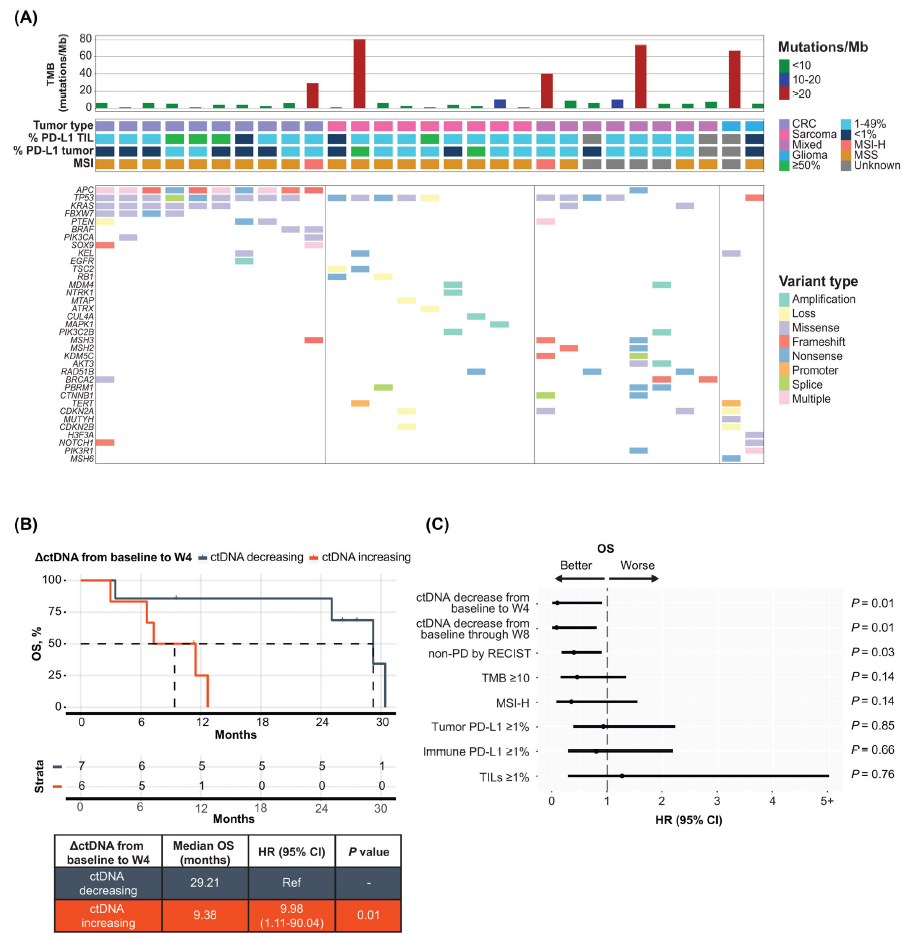
图2. ctDNA自基线至第4周水平与OS密切相关
ctDNA可对RECIST组患者分层 识别真正获益人群
早期ctDNA动态变化可识别免疫治疗真/假进展患者。结合RECIST 1.1标准评估的最佳疗效和治疗8周内的ctDNA水平变化可对最佳应答组进行分层(图3)。治疗8周内ctDNA水平下降的CR/PR/SD患者的OS最长。相反,第8周ctDNA水平上升最佳疗效为PD的患者OS最短(mOS:29.21 vs 7.29个月, P=0.007)。无论最佳疗效评价结果如何,治疗8周内ctDNA水平下降患者的OS皆优于ctDNA升高患者。8例最佳疗效评价结果为PD的患者中,3例患者第8周ctDNA水平为下降(图3),尽管PD时患者中止联合治疗,这些患者仍存在长期生存获益,中位OS为25.07个月。因此,早期ctDNA动态变化与肿瘤负荷相关。
第8周时,采用RECIST1.1标准评估影像学疗效,从基线到治疗后8周内的ctDNA水平变化可确定或改进与之时间相对应的疗效评价(图3B)。3位8周影像学评价为PD的患者,ctDNA水平下降,实际上有2位患者免疫治疗有长期获益,OS分别为26.32个月和25.07个月,这两位患者被评估为PD是因为疗效评价时骨和肺部出现新的病灶,其中1位患者靶病灶评估为PR,另外一位是因缺乏可测量的靶病灶,无法用RECIST1.1标准进行评估。7例患者治疗8周时评估为SD或non-CR/PD,其中2例治疗8周后ctDNA含量上升,OS仅为3.5个月和9.1个月,提示这两例患者不能从治疗中获益。
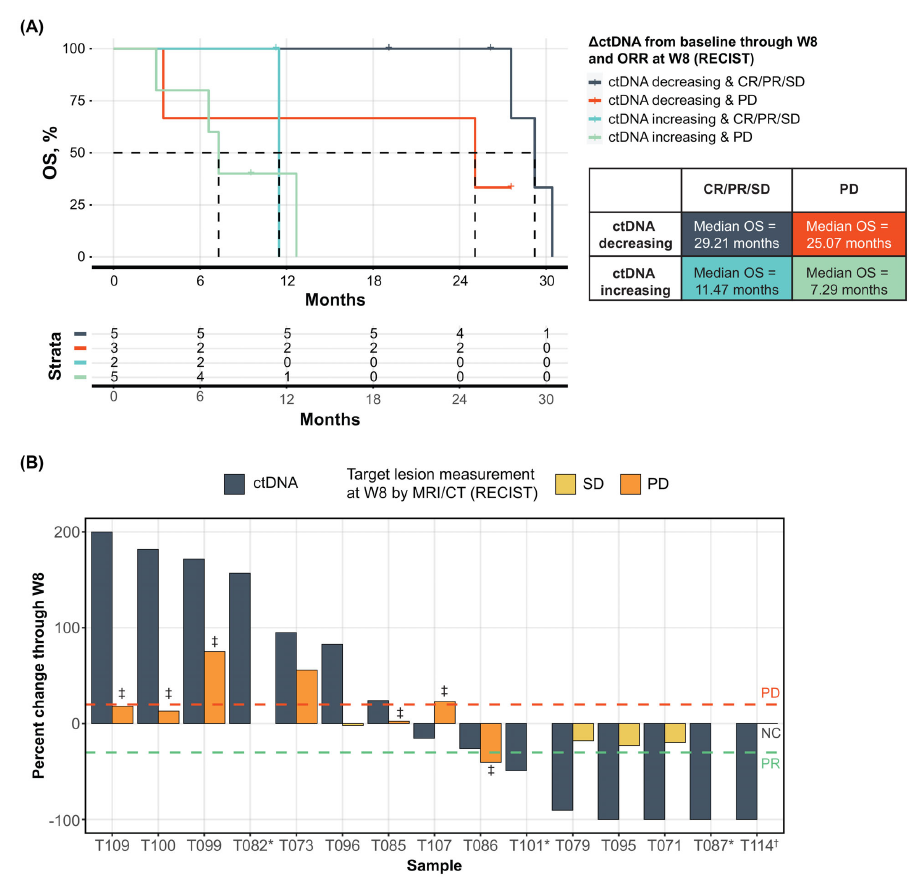
图3. ctDNA可识别长期生存获益患者
治疗过程中ctDNA清零患者与8周内ctDNA水平下降患者的OS获益类似,均显著优于ctDNA上升患者( mOS = 29.0 vs.11.5 个月, P = 0.03; 图4)。3例ctDNA清零患者中有2位在治疗8周时可测量靶病灶经RECIST1.1标准评估最佳疗效为CR。存在患者治疗8周时影像学疗效评价结果为SD,但是后期获得CR。ctDNA清零和影像学评效为CR的中位时间间隔为11.5个月(50周),和影像学评价治疗有效(CR或PR)的中位时间间隔为3.8个月(16.5周)。这表明这2例患者在使用ctDNA进行评估时具有时间领先优势。
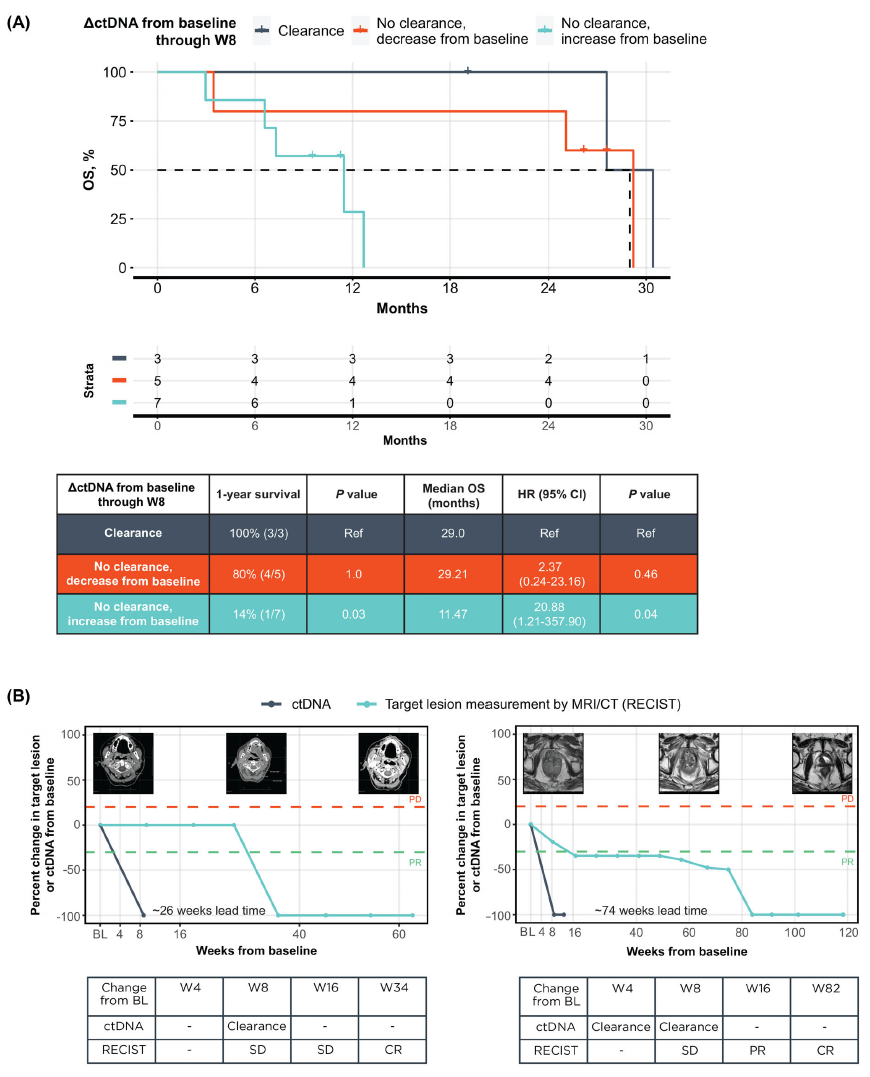
图4. ctDNA清除患者存在长期生存获益
讨论
本研究通过评估接受度伐利尤单抗和替西木单抗治疗的晚期实体瘤患者的基因组特征和ctDNA变化,旨在探寻ctDNA是否能成为稳健的、可预测泛癌种双免疫治疗长期生存获益的生物标志物。研究证实免疫治疗4周时的ctDNA下降可预测患者长期生存获益。此外,与既往标准免疫治疗疗效预测生物标志物(PD-L1、TMB、MSI-H)相比,ctDNA水平动态变化可提供纵向视角以评估肿瘤对于治疗方案的应答。
本文发现ctDNA动态变化可辅助患者治疗后的疗效评估,部分案例中可早于影像学评估提示肿瘤应答。治疗期间ctDNA上升可识别免疫治疗非获益且预后较差患者,以提示临床医生及时调整治疗策略。例如,治疗期间ctDNA上升,可考虑强化治疗(增加治疗剂量/频率)或更换治疗方案;对于ctDNA下降或清零患者,可考虑去强化治疗或暂停治疗,从而减轻患者不必须的的医疗及经济负担。后续需要进行更大规模研究以确认ctDNA作为泛癌种免疫治疗疗效预测生物标志物的适用性及可靠程度。
本研究ctDNA动态监测的策略是根据基线肿瘤组织检测结果进行个性化的跟踪和检测,可使临床医生基于基线组织检测结果选择个体化治疗方案,并利用非侵袭性的采血方式,对ctDNA进行动态检测、实时监测疗效,为及时调整治疗策略提供重要参考信息。ctDNA动态评估在不同瘤种患者中均具有OS预测的价值,表明其可作为影像学评估疗效的有力补充。






