
基于循环肿瘤DNA(ciuculating tumor DNA, ctDNA)的液态活检可以鉴别血液中新发突变,跟踪肿瘤克隆演化,提示药物应答情况和预后。通过监测ctDNA中的RAS突变状态,可对转移性结直肠癌(mCRC)患者的生存情况进行预测,这具有非常重要的临床意义,也是血液样本进行NGS检测的一个重要应用场景。求臻医学特邀厦门大学附属第一医院肿瘤内科汤玮玮教授,结合近期发表在Journal of Cancer Research and Clinical Oncology上的文章进行解读。
汤玮玮教授:抗血管内皮生长因子(VEGF)或抗表皮生长因子受体(EGFR)单抗联合化疗是mCRC的标准治疗方案,可显著改善患者预后,RAS突变是EGFR靶向治疗疗效的负性预测因子。诸多研究表明mCRC肿瘤组织中的RAS突变可独立预测患者预后,但是临床指南对于血浆样本中循环游离DNA(cfDNA)检测的预后意义以及使用场景仍无定论,因此血浆样本中RAS突变状态是否能独立预测mCRC患者的预后也一直在探索中。
该研究一共纳入81例既往接受过一线/二线治疗的mCRC患者,基线时采集静脉血并提取cfDNA进行基因检测。48.1%(39/81)的患者肿瘤组织中存在RAS突变,71.8%(n=28)的患者血浆样本中检出与原发肿瘤一样的RAS突变位点,为RAS突变持续检出患者;28%(n=11)的患者原发肿瘤中存在RAS突变,但是未在血浆样本中检出,为RAS突变未检出患者。进一步分析以上患者的生存情况,发现cfDNA水平升高与总生存期(OS)缩短显著相关;与血浆样本中RAS突变未检出的患者相比,有RAS突变检出患者的死亡风险增加,原发肿瘤组织的RAS突变对OS无显著影响。随着cfDNA中RAS突变数目的增加,生存期呈显著降低趋势,较高RAS突变数目患者的死亡风险比RAS突变未检出或低RAS突变数目患者高出5倍。多因素Cox回归分析表明血浆中RAS突变状态可独立于其它临床特征预测mCRC患者治疗结局。
综上,血浆样本中RAS突变状态可独立预测mCRC预后。约8-70%的RAS突变型mCRC患者在治疗后RAS突变未检出,这类患者可能获益于抗EGFR单抗治疗。但临床实践中需注意区分假阴性和真正的RAS突变未检出。利用NGS进行检测,可通过血浆样本中是否有其它体细胞突变检出来间接判断ctDNA含量是否足以保证RAS突变检出,最大程度降低假阴性,本研究中64%的RAS突变未检出患者中有其它突变检出。本研究进一步证实mCRC治疗过程中RAS突变未检出现象的存在,整合血浆RAS突变可为mCRC患者预后分层、指导治疗提供更充分的证据,可为后续治疗提供新的选择。
摘要 RAS突变是mCRC进行EGFR靶向治疗不良结果的预测因子,已被作为mCRC患者生存的预后生物标志物。本研究通过对血浆中RAS突变状态进行动态监测。发现与血浆中RAS突变未检出患者相比,RAS突变检出患者死亡风险升高。原发肿瘤组织中存在RAS突变,但是血浆中RAS突变未检出患者的生存期优于血浆中RAS突变检出患者。每毫升血浆中RAS突变数目显著影响患者预后,突变越多患者预后越差,高突变数目患者较无/低突变数目患者增加5倍死亡风险。因此,利用ctDNA进行RAS突变状态的动态监测在mCRC全程管理中具有重要临床价值。 研究背景 约25%的结直肠癌(CRC)患者初诊时即存在转移,约半数患者行原发灶根治术后仍会发展为mCRC,死亡率较高。多数情况下,mCRC是无法治愈的,其治疗目标是延长生存期和维持生活质量。抗VEGF与抗EGFR单抗联合化疗是mCRC的标准治疗方案,可显著改善患者预后。但具体治疗方案的选择要基于原发肿瘤的基因突变状态。 RAS(KRAS和NRAS)突变会导致RAS信号通路持续激活,进而导致抗EGFR单抗原发性耐药,目前临床指南建议所有mCRC患者在开始抗EGFR治疗前必须对原发肿瘤进行RAS突变检测。针对于携带RAS突变的患者,抗VEGF单抗联合化疗为首选治疗方案。RAS突变除可作为抗EGFR单抗疗效预测性标志物之外,还有诸多研究认为其可作为生存的独立预后生物标志物,对于预后的评估应结合原发肿瘤突变状态及治疗过程中因克隆进化或选择压力导致的突变丰度变化。基于ctDNA的液体活检可以鉴别血液中新发突变,跟踪肿瘤克隆演化,提示药物应答情况和预后。但目前血浆中RAS突变丰度的阈值尚未确定,也无指南推荐mCRC患者利用液体活检对RAS突变状态进行再次检测。为了更好地评价利用液体活检对RAS突变再次检测的价值,本文利用NGS对mCRC患者血浆中的RAS突变进行监测并评估其对临床结局的影响。 研究方法 研究入组2017年10月至2020年6月来自德国及奥地利两家医疗中心的mCRC患者,既往接受过一线/二线治疗。并收集患者临床病理学参数,包括年龄、性别、肿瘤组织病理学、RAS突变状态、转移情况、CEA水平、治疗方案及疗效。于基线时留存静脉血并提取cfDNA。对cfDNA中的KRAS突变热点(第2/3/4外显子)、NRAS突变热点(第2/3外显子)及其他候选基因(APC、BRAF、EGFR、FBXW7、PIC3CA、SMAD4、TP53)进行靶向测序分析。根据cfDNA浓度和突变丰度计算每毫升血浆中RAS突变数目。 研究结果 患者特征 研究共纳入81例mCRC患者用于分析。cfDNA浓度存在较大差异(中位14.9 ng/mL,2.8-420.0 ng/mL)。血液中,37%(30/81)的患者携带RAS突变,其中KRAS突变患者26例,NRAS突变4例,患者临床病理学特征见表1。48.1%(39/81)的患者肿瘤组织中检出RAS突变,71.8%(n=28)的患者血浆样本中检出与原发肿瘤一样的RAS突变。28%(n=11)的患者原发肿瘤中存在RAS突变,但是未在血浆样本中检出,此类患者归类于RAS突变未检出患者。RAS突变未检出患者中63.6%(n=7)的患者检出RAS以外的其它突变。组织和血液中均检测到RAS突变的患者中,85.7%(n=24)存在RAS以外的突变。
表1. 液体活检不同RAS突变状态患者的临床病理学特征
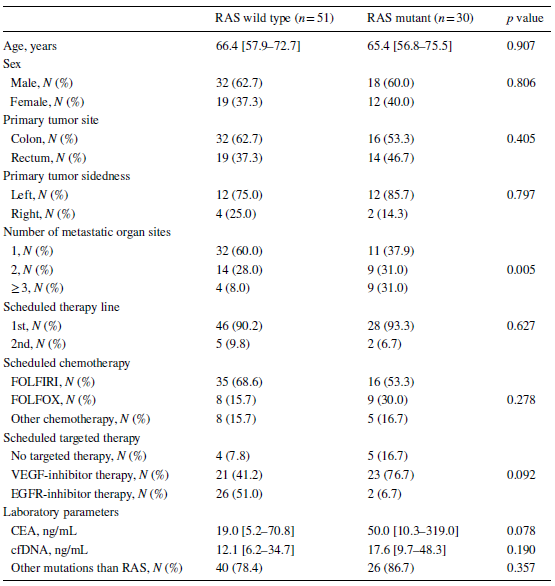
血浆RAS突变状态
计算每毫升血浆中RAS突变数目。根据结果将患者分为三组,分别为RAS突变未检出组(0 RAS突变/毫升)、RAS突变低浓度组(11-377 RAS突变/毫升)及RAS突变高浓度组(1078-64,423 RAS突变/毫升)。仅血浆cfDNA水平与每毫升血浆RAS突变数目呈显著相关。RAS突变的持续检出与CEA水平和转移部位数目显著相关。
RAS突变状态对生存期的影响 经过中位26.5个月的随访,53.1%患者死亡。cfDNA水平升高与OS缩短显著相关(HRper SD =1.34,P=0.030)。与血浆样本中无RAS突变检出的患者相比,有RAS突变患者死亡风险增加(HR=2.16,P=0.013)。相反,原发肿瘤的RAS突变状态对OS无显著影响。相应生存曲线及相关性分析见图1a、b。RAS突变未检出患者的OS优于RAS突变持续检出患者(图1c)。每毫升血浆中的RAS突变数目与治疗最佳应答呈显著相关。三组患者生存曲线见图1d,随着每毫升血浆中RAS突变数目的增加风度升高,生存期呈显著降低趋势
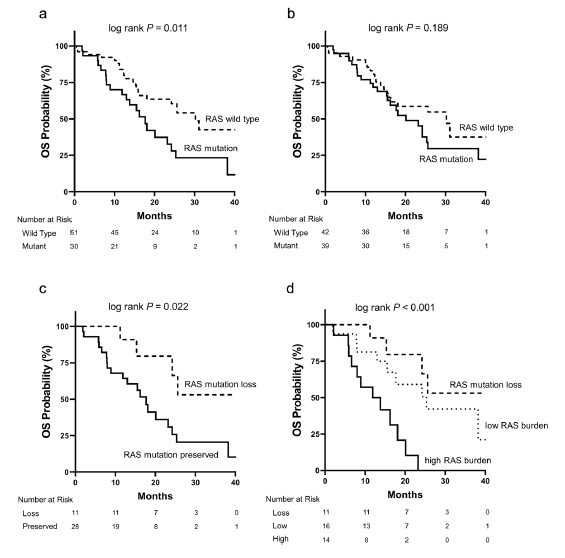
图1. 根据不同RAS突变状态预估OS累计可能的生存曲线
通过统计分析,将1000 个RAS突变/ml设为血浆RAS突变检测初始阈值。RAS突变浓度≥1000 拷贝/mL的患者较RAS突变未检出患者/RAS突变低浓度患者增加5倍死亡风险(图2a),RAS突变浓度可显著预测OS(图2b),几种模型得出结论一致(Model1:未校正;Model2:经年龄、转移灶数目和CEA校正;Model3:在Model2基础上再增加性别、原发灶位置,治疗线数和化疗情况)。
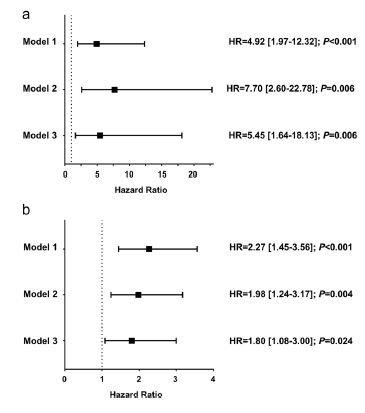
图2. RAS突变丰度与OS的相关性
讨论 本研究发现血浆RAS突变状态及浓度对于CRC患者预后产生重要影响,但通过液体活检进行常规RAS突变分析还需要更多证据。 肿瘤预后是患者极其关注的问题,也是临床治疗决策制定的主要驱动因素。CRC原发灶的RAS突变状态与不良预后有关;但也有报道并未发现RAS突变与不良预后之间的联系,本研究结果与后者一致,即原发肿瘤RAS突变与生存的关联并未达到统计学差异,而液体活检的RAS突变状态与OS显著相关,可能由于部分患者中血浆中RAS突变状态与原发肿瘤组织有所差异。 RAS突变状态在原发肿瘤组织与血浆之间最常见的差异即为血浆中无法检测到原发灶携带的RAS突变,即RAS突变未检出。值得关注的是这类患者的生存较突变持续检出患者有改善。作者认为可能是由于抗VEGF治疗导致RAS突变细胞中活性氧清除率降低,诱发氧化应激,进而导致选择性铁死亡。但目前此观点尚有争议。本研究中大多数患者在初始治疗前采集血样,未发现血浆RAS突变状态与治疗方案的相关性。因此,可能无法充分阐释RAS未检出的原因。 RAS突变状态的变化是临床关注的热点之一,可为初始RAS突变mCRC患者的二线抗EGFR治疗提供依据。因此,从RAS未检出患者中区分假阴性RAS突变患者至关重要。本研究显示RAS突变未检出与cfDNA低浓度呈显著相关。因此血浆cfDNA浓度低可导致ctDNA浓度低,进而导致RAS突变的假阴性结果,建议利用其它体系突变的检出与否间接证实ctDNA浓度是否足以保证RAS突变的成功检出。对RAS低突变丰度患者进行血浆样本的持续监测,可以助力临床前瞻性筛选择适合抗EGFR治疗的患者。






