伴随着NGS在胰腺癌临床精准诊疗中的应用,越来越多有益于临床诊疗的标志物逐渐得以验证。通过基因检测并结合相关基因突变状态辅助临床选择使患者获益的术前新辅助化疗方案,从而达到指导临床个性化治疗的目的,这也是NGS助力临床精准诊疗的一个重要应用价值。求臻医学特邀青岛市中心医院肿瘤综合治疗科季有信教授,结合近期发表于Clinical Cancer Research上的文章进行解读。
季有信教授:胰腺癌是常见的消化系统恶性肿瘤之一,因其疾病进展迅速,生存时间短,在肿瘤领域素有“癌症之王”的称号。而胰腺导管癌(PDAC)作为胰腺癌最常见的亚型,手术切除仍然是PDAC获得治愈机会和长期生存的唯一有效方法,但近年来PDAC长期生存率的提高主要是得益于系统治疗的进步。新辅助治疗可提高R0切除率,改善患者OS,且依从性好,在PDAC临床中的应用越来越广泛。如何利用现有的NGS检测寻找可预测新辅助方案选择的生物标志物,进而指导PADC围手术期个体化治疗,是目前临床比较关注和想要探寻的方向。
此篇发表于Clinical Cancer Research上的研究探寻了可预测新辅助化疗疗效的分子标志物,为此类研究奠定理论基础。该研究纳入322例局限期PDAC患者,初始接受至少一周期FOLFIRINOX方案或吉西他滨/白蛋白紫杉醇方案治疗。利用NGS检测评估了4个驱动基因(KRAS、TP53、CDKN2A、SMAD4)的体系突变与不同治疗方案之间的转移进展率、手术切除率和MPR率的相关性。研究结果显示,1/5 PDAC患者存在SMAD4突变,在新辅助FOLFIRINOX方案治疗的患者中,SMAD4突变是唯一与转移进展率(30.0% vs. 14.5%;P=0.009)及手术切除率下降(37.1% vs. 66.7%;P<0.001)显著相关的基因。但在新辅助吉西他滨/白蛋白紫杉醇方案中,SMAD4突变与转移进展及手术切除率下降不相关。
本研究通过对接受新辅助化疗的局限期PDAC患者进行基因检测分析,揭示SMAD4突变与FOLFIRINOX方案新辅助治疗较差的临床结局相关联,而与新辅助吉西他滨/白蛋白紫杉醇方案不相关。提示SMAD4可能是指导PDAC新辅助化疗方案选择的预测性生物标志物,未来有望通过基因检测,结合相关基因突变状态选择患者术前新辅助化疗方案,进而达到指导临床个性化治疗的目的。伴随着NGS在胰腺癌精准诊疗中应用,越来越多预测性分子标志物将在临床实践中得以验证,从而为胰腺癌患者提供精准的临床用药参考,及时选择最有效的个性化治疗方案,才能让更多患者实现最大获益。
摘要
在局限期胰腺导管腺癌(PDAC)治疗方案中,新辅助治疗在临床中应用逐渐增多,但鲜有标志物指导治疗方案的选择。本研究纳入322例局限期PDAC患者,初始接受至少一周期FOLFIRINOX方案或吉西他滨/白蛋白紫杉醇方案治疗。经NGS检测评估4个驱动基因(KRAS、TP53、CDKN2A、SMAD4)的体系突变。发现在一线接受FOLFITINOX方案治疗的患者中,SMAD4突变是唯一与转移进展率(30.0% vs. 14.5%;P=0.009)及手术切除率下降(37.1% vs. 66.7%;P<0.001)显著相关的基因。但接受吉西他滨/白蛋白紫杉醇方案诱导治疗的患者,SMAD4突变与转移进展率及手术切除率下降不相关。SMAD4不仅是预后指标,也是指导治疗选择的预测指标。这些数据支持无论分期如何,应对PDAC患者进行常规基因测序以指导预后和治疗方案选择。
研究背景
预计到2030年,PDAC将成为美国第二大癌症相关死亡原因。尽管手术是治愈早期PADC患者的唯一手段,但近年来辅助治疗也取得了很大进步。吉西他滨联合白蛋白结合型紫杉醇方案或FOLFIRINOX方案应用于辅助治疗可显著提高患者总生存,在新辅助治疗方案中的应用也逐渐增多。生物标志物可指导个体化治疗,近期研究发现PDAC肿瘤独特具有不同的分子特征,如最近报道的KRAS、TP53、CDKN2A、SMAD4。本团队之前研究发现SMAD4突变患者接受FOLFIRINOX诱导治疗的疾病进展率较高,但是因无其它化疗方案做对比,无法明确SMAD4是预测还是预后生物标志物。本研究对接受新辅助化疗的PDAC患者治疗前原发肿瘤组织进行NGS测序,并评估其与临床结局的相关性。旨在确定SMAD4突变患者接受吉西他滨联合白蛋白结合型紫杉醇方案或FOLFIRINOX方案治疗是否存在疗效差异,及SMAD4突变是否可预测早期的转移性疾病进展或手术失败率。
研究方法
研究入组2011年1月至2020年12月在纪念斯隆-凯特琳癌症中心连续接受至少一周期FOLFIRINOX方案或吉西他滨/白蛋白紫杉醇方案治疗的局部晚期PDAC患者。组织标本经MSK-IMPACT测序,涵盖505个癌症相关基因,血液样本检测胚系突变。SMAD家族突变指SMAD2、SMAD3、SMAD4、TGFbR1或TGFbR2中任何基因发生突变。在ARID1A、ATM、BAP1、BARD1、BLM、BRCA1、 BRCA2、BRIP1、CHEK2、FAM175A、FANCA、FANCC、NBN、PALB2、RAD50、RAD51、RAD51C及 RTEL1中进行同源重组缺陷(HRD)分析。主要研究终点为:1、诱导化疗期间的转移进展率,2、手术切除率,3、手术切除患者中主要病理反应(MPR)发生率。共入组322名患者,84.2%(N=271)的患者接受FOLFIRINOX方案治疗,15.8%(N=201)的接受吉西他滨联合白蛋白结合型紫杉醇方案治疗,FOLFIRINOX方案在相对年轻患者中应用较多(中位年龄64岁 vs 73岁)。54%患者接受放疗,主要包括体外放射治疗(78.9%)及立体定向体放射治疗(10.9%)。
研究结果
临床基因组特征
患者基本特征见表1。基因组突变图谱见图1。KRAS、TP53、CDKN2A、SMAD4突变率分别为87.0%、65.5%、26.7%及19.9%。26%患者存在至少一个SMAD家族基因体系突变(SMAD4,N=64;SMAD2,N=1;SMAD3,N=2;TGFbR1,N=7;TGFbR2,N=12)。
表1. 患者临床病理学特征
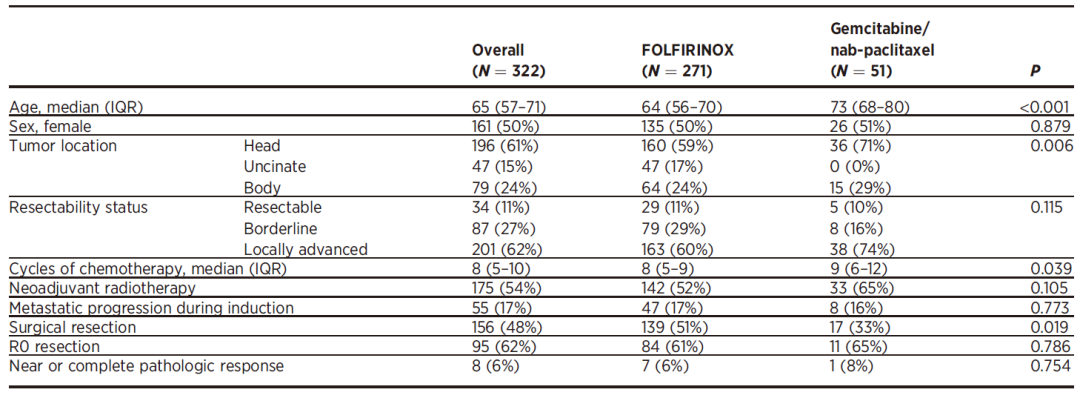

图1. 按照一线化疗分层的基因突变比例
诱导化疗中的转移进展
整体队列中诱导化疗后发生转移的患者占17.1%(图2A)。转移进展与KRAS、TP53、CDKN2A突变无关。相反,SMAD4突变与诱导治疗中的高转移率呈显著相关(SMAD4MUT:26.6% vs SMAD4WT: 14.7%; P=0.024)。同时,SMAD家族亦与诱导治疗中的疾病转移相关(MUT:24.1% vs WT:14.6%;P=0.049)。接受FOLFIRINOX方案或吉西他滨/白蛋白紫杉醇方案的转移率无明显差别(17.3% vs 15.7%)。
FOLFIRINOX方案队列中,SMAD4突变仍与疾病转移相关(SMADMUT: 30.0% vs SMADWT: 14.5%,P=0.009)。SMAD家族突变亦如此(SMAD4MUT:27.4% vs SMAD4WT: 14.4%,P=0.017)。相反,吉西他滨/白蛋白紫杉醇方案诱导队列中,SMAD4突变、SMAD家族突变均与疾病转移不相关。
诱导化疗后的手术切除率
48.4%(N=322)的患者完成手术,排除转移进展的患者后,分析驱动基因突变对肿瘤缩小以实现手术切除的影响(图2B)。接受FOLFIRINOX方案治疗患者手术切除率高于接受吉西他滨/白蛋白紫杉醇方案治疗患者(62.1% vs 39.5%;P=0.006)。FOLFIRINOX方案队列中,SMAD4突变与切除率下降相关(SMAD4MUT:37.1% vs SMAD4WT:66.7%;P<0.001)。但SMAD4突变对吉西他滨/白蛋白紫杉醇方案治疗后的手术切除率无显著影响(SMAD4MUT:33.3% vs SMAD4WT:41.9%;P=0.605)。
诱导化疗后的病理学缓解率
接受手术切除且有病理学缓解率数据的128例患者中,1例(0.8%)患者出现病理学完全缓解,7例(5.5%)患者有轻微残余癌(<5%活肿瘤细胞)。这与是否存在驱动基因无关。完全/接近完全病理缓解率与化疗方案无关(图2C)。任何HRD基因的体细胞突变均与病理反应率及化疗方案无关。研究未评估HRD的胚系改变。
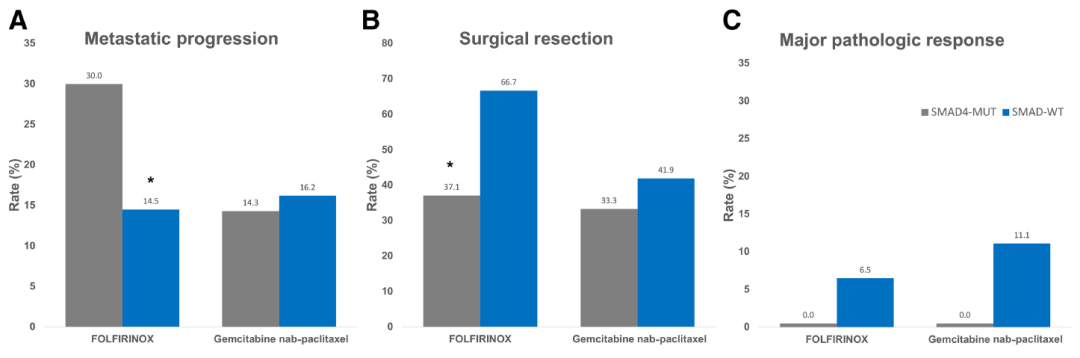
图2.SMAD4突变与A.诱导化疗期间的转移率、B.手术切除率、C.MPR率的关系
讨论
多种化疗药物的联合治疗已为转移性PDAC 的生存结局带来改善。然而,PDAC仍是死亡率最高的瘤种之一。改善患者预后的直接策略之一是确定预测性生物标志物,以指导全身治疗选择。本研究在局限期PDAC患者队列中进行肿瘤突变测序,揭示SMAD4突变与FOLFIRINOX方案新辅助治疗较差的临床结局之间的关联。1/5患者存在SMAD4突变,在接受FOLFIRINOX方案治疗患者中,SMAD4突变与肿瘤转移及手术切除率下降有关,但接受吉西他滨/白蛋白紫杉醇方案治疗患者则不受影响。突出强调了根据基因特征选择一线诱导化疗方案的潜在可行性。
本研究存在一些局限性。首先,化疗方案的非随机选择表明在SMAD4MUT与FOLFIRINOX方案诱导治疗失败存在关联,但不能排除这些可能由于吉西他滨/白蛋白紫杉醇及FOLFIRINOX队列之间患者临床特征的差异所导致,如患者年龄、肿瘤部位和完成化疗的周期数等。考虑到年龄差异,FOLFIRINOX和吉西他滨/白蛋白紫杉醇队列之间的剂量强度也可能存在差异。其次,临床中较少使用吉西他滨/白蛋白紫杉醇进行诱导治疗,导致研究说服力不足。第三,研究入组的患者是成功进行NGS检测的患者,可能存在部分转诊偏倚。第四,诱导化疗前用诊断性腹腔镜进行手术分期不是研究惯例,不能排除部分患者在就诊时已存在隐匿性转移疾病。