
近年来,伴随肿瘤靶向、免疫、核素治疗的发展,泌尿肿瘤领域取得长足进步。特别是以基因检测为代表的精准医学在泌尿肿瘤中的广泛应用,正在快速改变泌尿肿瘤领域诊疗模式。求臻医学聚焦重磅研究,紧追前沿热点,对泌尿肿瘤领域前沿进展进行梳理,特推出“探泌臻知”系列栏目。本期,我们将着重介绍FGFR抑制剂在尿路上皮癌中的应用及相关研究进展,快跟随求小臻一起学习吧~
什么是FGFR
FGFR(Fibroblast Growth Factor Receptor)全称成纤维生长因子受体,由胞外配体结合域、跨膜结构域和胞内酪氨酸激酶结构域组成,主要包括FGFR1、FGFR2、FGFR3、FGFR4四种受体亚型,另一种亚型有成纤维生长因子(FGF)配体结合能力但缺乏细胞内激酶结构域(FGFR5)。FGFR与表皮生长因子受体(EGFR)同属于受体酪氨酸激酶(RTK)家族,通过与配体结合,诱导FGFR形成二聚体,并催化自身发生磷酸化,激活四个关键的下游信号通路:RAS-RAF-MAPK,PI3K-AKT,信号转导子和转录激活子(STAT)以及磷脂酶Cγ(PLCγ),将细胞外信号传递到细胞内,从而促进细胞生长,分化,迁移,凋亡等,FGFR信号通路异常将直接驱动肿瘤发生发展[1]。
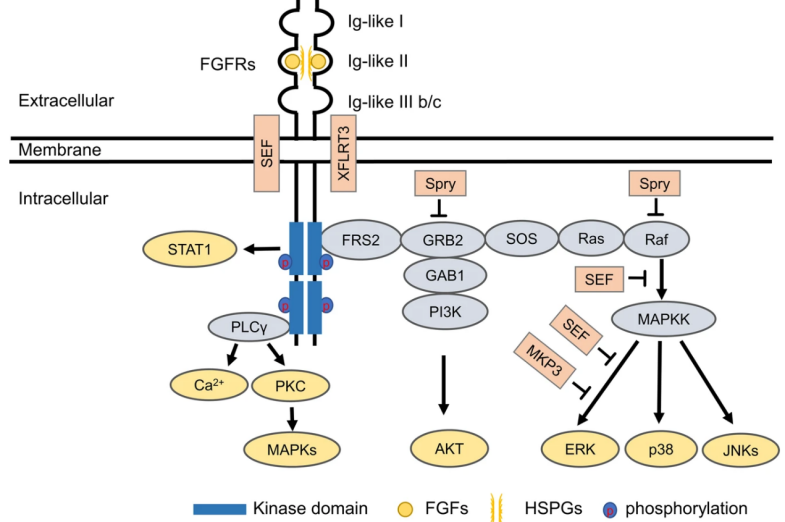
图1. FGFR信号通路
尿路上皮癌中FGFR基因变异频率
在肿瘤细胞中,FGFR信号通路可以通过编码区的扩增、错义或融合突变,也可以通过非编码区的异常调节,或者通过表观遗传调节子的改变或配体的上调被组成型激活。FGFR 信号通路的异常,特别是 FGFR1 和 FGFR3 的改变,已被证明与尿路上皮癌(Urothelial Carcinoma,UC)有关[2]。
据报道,大概32%的UC中存在FGFR异常,7%的UC患者存在FGFR1扩增,FGFR1扩增是FGFR1基因的主要变异类型。FGFR1基因的两种剪接变体(FGFR1α和FGFR1β)在正常尿路上皮细胞中均等表达,但在尿路上皮癌中以FGFR1β表达为主。UC中最常见的FGFR3变异为激活型,约占UC的15%[3,4]。Billerey等人报道,在84%(27/32)G1、55%(16/29)G2 和7%(5/71)G3级别非肌层浸润性膀胱癌(non-muscle- invasive bladder cancer,NMIBC)中,和大约10%的肌层浸润性膀胱癌(muscle-invasive bladder cancer,MIBC)检测到FGFR3突变,FGFR3变异与低级别膀胱癌高度相关(p<0.0001)[5-7]。与FGFR3和FGFR1相比,FGFR2在UC中表达量较低,其低表达与较差的预后相关[8]。有文献报道,在UC细胞系中FGFR2异构体如FGFR2-IIIb与体外增殖减少和裸鼠致瘤性减弱相关[9]。目前暂无FGFR4和FGFR5在UC中的相关研究报道。
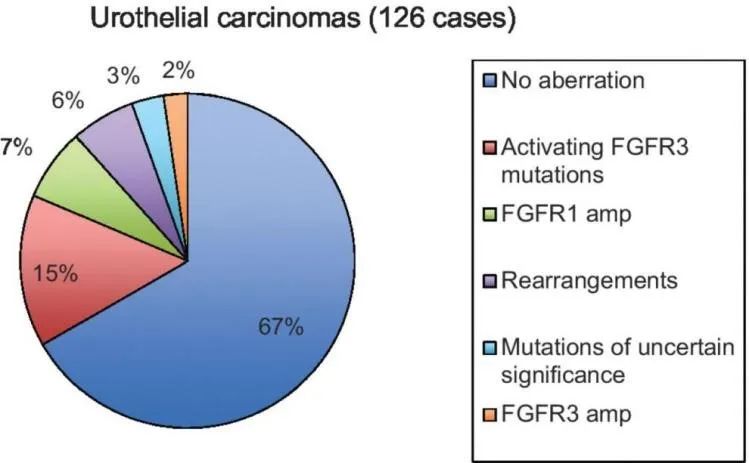
图2. 尿路上皮癌中FGFR基因变异频率
FGFR抑制剂在尿路上皮癌中的临床研究进展
局部晚期或转移性尿路上皮癌患者一线治疗主要以铂类化疗为主,有效率为50%左右,中位无进展生存时间为6-9个月。而对于铂类化疗进展的患者,二线治疗推荐使用免疫检查点抑制剂,客观缓解率为13-21%。随着FGFR抑制剂的问世,晚期尿路上皮癌的靶向治疗也获突破。
据报道,FGFR突变在尿路上皮癌中高频检出,大概32%的UC中存在FGFR突变[3]。2019年4月,FDA批准FGFR抑制剂厄达替尼(Erdafitinib),用于治疗携带FGFR2/3突变或融合,在铂类化疗期间或化疗后(包括在新辅助化疗或辅助化疗一年内)出现疾病进展的局部晚期或转移性尿路上皮癌成人患者,这是FDA批准的首款尿路上皮癌靶向治疗药物,也是第一款获批的FGFR抑制剂,标志着尿路上皮癌进入了靶向治疗的新时代。目前除厄达替尼之外,其它FGFR抑制剂Pemigatinib和Infigratinib相继获批用于胆管癌。作为热门靶点之一,已有多款FGFR激酶抑制剂在尿路上皮癌中开展探索研究。
厄达替尼(Erdafitinib),一种口服泛FGFR酪氨酸激酶抑制剂。该药的加速获批主要基于这项多中心、开放标签的单臂临床II期研究(BLC2001,NCT02365597),该研究旨在评估Erdafitinib在局部晚期或转移性尿路上皮癌患者中的有效性和安全性。所有患者在接受至少一个化疗期间或之后,或新辅助或辅助化疗一年内均有疾病进展。共99例患者入组,入组人群需携带至少一种FGFR3突变(R248C、S249C、G370C、Y373C)或FGFR融合(FGFR3-TACC3、FGFR3-BAIAP2L1、FGFR2-BICC1、FGFR2-CASP7)。主要研究终点是客观缓解率(Objective Response Rate,ORR),次要研究终点包括:无进展生存期(Progression Free Survival,PFS)、缓解持续时间(Duration of Overall Response,DoR)和总生存期(Overall Survival,OS)。
结果显示,在所有患者中,客观缓解率为40%,其中完全缓解为3%,部分缓解为37%;在既往接受过免疫治疗的22例患者中,客观缓解率为59%。中位无进展生存期为5.5个月,中位生存期13.8个月。其中FGFR3突变患者ORR为49%;FGFR3融合患者ORR为16%[10]。
此外,另一项III期(NCT03390504)临床研究也在进行中,旨在对比厄达替尼VS化疗or帕博利珠单抗在FGFR突变的晚期尿路上皮癌中的疗效差异,主要研究终点是OS。现阶段,在晚期尿路上皮癌中免疫治疗仍为二线治疗首选,化疗也是二线治疗的选择,厄达替尼临床应用阶段能否进一步前移还需更多的探索。
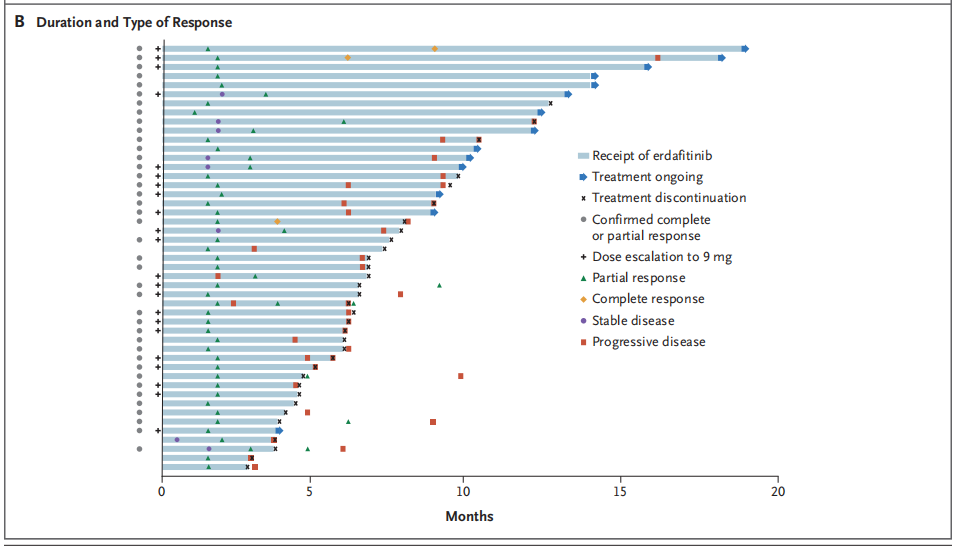
图3. Erdafitinib在局部晚期或转移性尿路上皮癌患者中的反应
Pemigatinib,FDA批准的第二款FGFR抑制剂,适应症为携带FGFR2基因融合或其它重排类型的经治晚期胆管癌成人患者,是全球首款用于晚期胆管癌的靶向疗法。目前在膀胱癌中也有相关研究正在进行中。如评估Pemigatinib在携带 FGF/FGFR突变的转移性或手术无法切除的尿路上皮癌中疗效和安全性的FIGHT-201研究(NCT02872714),目前已有中期研究进展在《ANNAL OF ONCOLOGY》杂志上报道,该研究分为队列A(FGFR3突变/融合,n=64)和队列B(其他FGF/FGFR突变,n=36),以队列A的ORR为主要临床终点。截止至2018年2月7日,队列A的ORR(包括未确认的PR)为25%(95% CI, 14%–40%),队列B中,仅1例 具有FGF10扩增的患者具有未确认的PR[11]。
另一项II期临床试验(NCT03914794)正在评估该药物对NMIBC患者的抗肿瘤活性,这些患者在行TURBT前接受4-6周的Pemigatinib治疗。主要终点是完全缓解率,该研究目前正在招募中。对于Pemigatinib在尿路上皮癌中疗效的确认仍需大规模的临床研究进行进一步的探索。
Infigratinib (BGJ398),一种口服给药的选择性广谱FGFR抑制剂。2021年5月28日获批用于已接受过治疗、携带FGFR2融合或重排的局部晚期或转移性胆管癌患者,是胆管癌获批的第二款FGFR靶向抑制剂,在膀胱癌中也显示出一定的治疗效果。在BGJ398的 I 期试验中,五分之四的携带 FGFR3 突变的晚期UC患者治疗后肿瘤消退[12]。基于此,另一项临床研究招募了67例FGFR3变异的晚期尿路上皮癌患者以进一步评估Infigratinib的疗效。患者以125mg/天的剂量口服单剂Infigratinib 治疗(给药三周/停药一周)。主要研究终点是ORR。在67例接受治疗的患者中,ORR为25.4%,其中38.8%患者疾病稳定,疾病控制率为64.2%。最常见不良反应包括高磷血症、肌酐升高、疲劳、便秘、食欲下降等[13]。
最近,Dizman等在一项II期试验中进行了探索性分析,比较了伴有FGFR3激活突变和/或融合的上尿路上皮癌(UTUC)和下尿路上皮癌(UBC)患者之间Infigratinib疗效的差异,共67例患者入组(UTUC 8例, UBC 59例),其中UTUC ORR为50%(1例CR、3例PR),疾病控制率为100%。UBC ORR为22%(13例PR),疾病控制率为59.3%。Infigratinib疗效在UTUC和UBC中存在明显差异,但考虑到仅8例UTUC患者入组,Infigratinib在UTUC和UBC中的疗效差异但仍需大型临床研究进行进一步验证[14]。
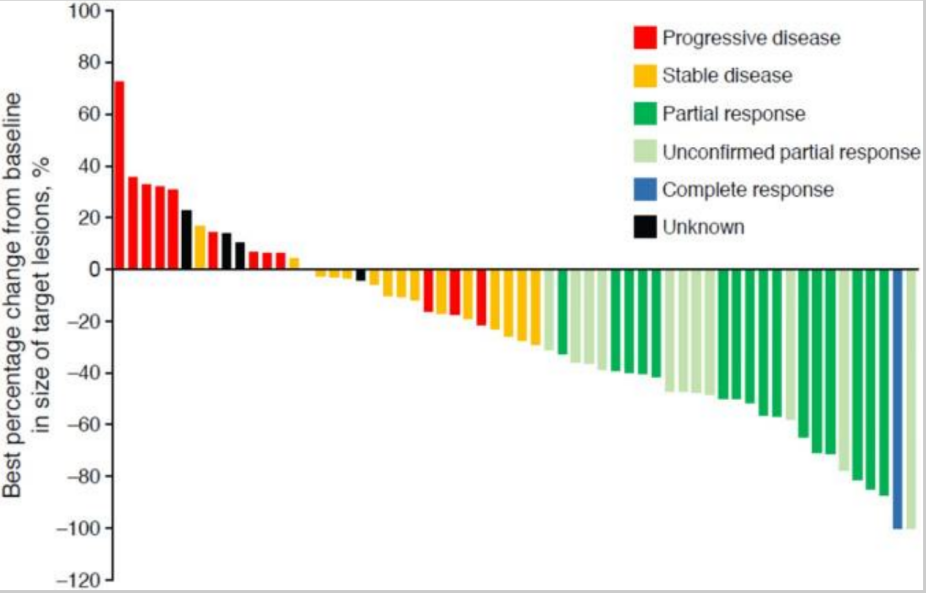
图4. FGFR3改变的晚期尿路上皮癌患者对BGJ398 治疗的应答
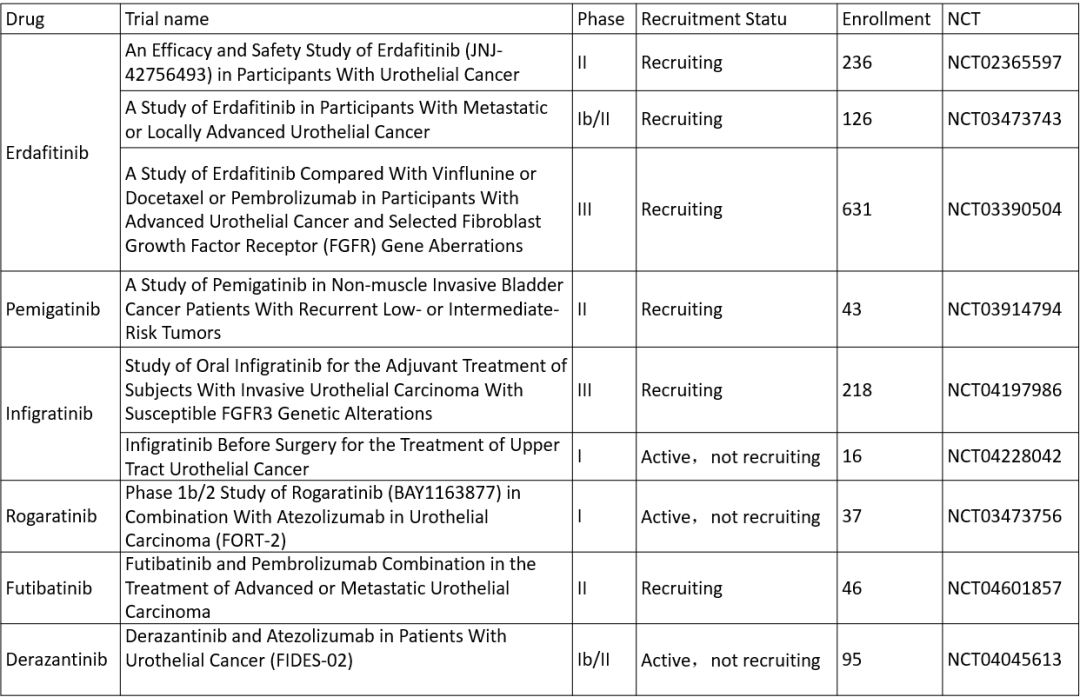
此外,靶向FGFR的药物如Derazantinib(ARQ087),目前正在进行Ib/II期临床研究(NCT04045613),以评估该药物单独或与阿替利珠单抗联合在携带FGFR突变的晚期UC患者中的疗效。另几种FGFR抑制剂如Futibatinib(TAS-120)、Rogaratinib(BAY 1163877)等最近在实体瘤治疗中也显示出积极的结果[15,16],在尿路上皮癌的临床试验正在招募中,我们期待更多令人鼓舞的临床数据发布。表1总结了FGFR抑制剂在尿路上皮癌中正在进行的相关临床试验。
表1. FGFR抑制剂在尿路上皮癌中相关临床试验汇总
小结与展望
FGFR作为目前“泛瘤种”治疗的热门靶点之一,目前已有3种FGFR抑制剂(厄达替尼、Pemigatinib和Infigratinib)获FDA批准上市。基于FGFR 突变在尿路上皮癌中的异常表达,以厄达替尼斩获FDA适应症为里程碑,已有多款FGFR抑制剂在尿路上皮癌中展开相关探索。整体而言,虽现阶段FGFR抑制剂还有待发展,我们相信随着更多临床研究的不断推进,这一“实力靶点”在尿路上皮癌中终会有更多的应用!
求臻医学
泌尿系列肿瘤基因检测方案
求臻医学从临床诊疗痛点出发,与泌外科顶级专家团队开展深度合作,结合最新研究进展深度打磨泌尿系列专属产品,全面覆盖前列腺癌、膀胱癌、肾癌等泌尿肿瘤多个治疗阶段,满足临床不同需求;同时针对患者疾病诊疗史进行个体化精准解读,辅助临床治疗决策;作为《中国肿瘤基因图谱计划》(CGAC)项目的转化成果,该系列产品定制化设计了国内外泌尿肿瘤高频突变基因panel,紧跟泌尿前沿贴近中国临床实践;通过指导肿瘤精准用药、疗效监控及健康管理提供全面有效的参考信息,为泌尿肿瘤患者保驾护航!






