臻知识·专家访谈 | 第05期

尽管分子残留病灶(MRD)评估可有效提示结肠癌患者接受治疗后的治愈情况,但仍需更可靠的生物标记物,近期研究显示,ctDNA可“担此大任”,它可以指导MRD的评估,具有改变结肠癌治疗模式的潜力!求臻医学特邀天津医科大学总医院刘刚教授,结合近期发表于Cancers (Basel)上的,有关以NGS为基础的术后ctDNA动态监测可预测CRC患者术后复发风险的研究进行专业解读。
刘刚教授:越来越多的数据表明,基于临床血液肿瘤标志物、病理以及影像评估的危险因素对结直肠癌(CRC)患者进行辅助化疗的选择不够完善、很难达到最佳临床治疗指导效果,导致大量CRC患者可能出现过度治疗或治疗不足,化疗以及靶向、免疫治疗等策略的决定亟需更为前沿和先进的标志物作为指导。现有的MRD,即微小残留病灶检测,是一种高灵敏度且可靠的生物标志物,受到越来越广泛的关注,其应用范围不断扩大,临床价值日益受到重视。
既往的研究报道中,ctDNA可以作为早期CRC患者术后MRD的可靠生物标志物。因此,结肠癌NCCN 2021.V2版指南在“可切除结肠癌辅助化疗”的讨论部分新增了“ctDNA”,指出:一些检测方法已被开发出来,希望能够提供预后和预测信息,以帮助决定II期和III期结肠癌患者的辅助治疗。
今天分享的这篇研究,再次验证了基于ctDNA指导的MRD对术后结肠癌患者预后及预测的实用性。该研究利用NGS对CRC患者术前、术后及化疗ctDNA进行动态检测。约45%患者术前ctDNA检出突变。此外,基线ctDNA阳性患者T分期较高、血管及周围神经浸润几率较高,且外周血及腹腔积液CEA水平较高。与既往研究结果相一致,这些数据表明由于肿瘤坏死及凋亡,肿瘤分期对ctDNA水平有较大影响。周围血管及神经浸润亦与基线ctDNA阳性有关。同时检测到与CRC发生发展相关的基因(TP53,APC、KRAS、FBXW7等),术后持续存在ctDNA检测到相关基因突变的患者,更易观察到血管侵犯和神经周围侵犯,提示这些基因与CRC复发有一定联系。
本研究中,发现术后ctDNA突变率下降了14.3%。术后及化疗后ctDNA清零的患者均未出现复发。值得注意的是,3例R0切除患者术后10天ctDNA仍为阳性的患者出现复发。未接受R0切除的患者,术后ctDNA仍为持续阳性提示有肿瘤残留。这些数据为术后ctDNA用于疾病状态分层和复发风险的有效性评估提供了证据。
综上所述,该研究验证了利用NGS对多种基因多种突变进行检测的必要性。同时研究结果表明,ctDNA动态监测可以预测CRC术后复发风险,有助于CRC术后风险管理,为高危个体提供了持续动态监测,可最大限度缩短治疗失败的等待时间,为制定个体化治疗策略,延长改善CRC患者的预后生存期提供了新的机遇。
摘要
本研究旨在探索结直肠癌(CRC)患者的循环肿瘤DNA(ctDNA)突变特征及其复发预后价值。利用NGS对49例CRC患者的血液样本进行动态检测,基线ctDNA阳性检出率为44.9%(22/49),中位的等位基因突变频率为0.74%(range: 0.10–29.57%),其中突变频率最高的为TP53突变(34.7%)、其次为APC (18.4%)、KRAS (12.2%)、FBXW7 (8.2%)、NRAS (2.0%)、PIK3CA(2.0%)和SMAD4 (2.0%)。术后ctDNA阳性率为14.3%(5/35),ctDNA阳性患者在随访过程中均出现复发或转移,其中有3名患者是R0切除患者。本研究结果提示,术后ctDNA可预测CRC患者术后复发风险,有助于及早指导后续精准的治疗策略。
研究背景
ctDNA是由肿瘤细胞在凋亡或坏死过程中产生的游离DNA,包含肿瘤特异性突变通过肿瘤患者的外周血即可进行检测,具有无创/微创、简单、可反复检测、能动态反应肿瘤基因突变状态等优势。在CRC中,ctDNA可作为疗效、预后预测、微小残留病灶(MRD)及复发监测的微创标记物。Sanger测序等传统的DNA分析方法灵敏度低,无法满足对于肿瘤复发监测的要求,基于杂交捕获的NGS测序可富集感兴趣的基因组目标区域,且灵敏性较高,有望解决这一问题。本研究收集CRC患者术前/术后/化疗后的血液样本进行ctDNA检测,意在探讨NGS用于鉴别术后复发高危个体的可行性及监测的最佳时间节点。
研究方法
纳入2018-2019年入组的49例CRC患者,中位年龄64岁。其中44例患者为R0切除,术后接受FOLFOX方案的辅助治疗。其余5例患者为R1/R2切除,术后接受标准化疗(FOLFOX方案/FOLFIRI方案)联合贝伐珠单抗/西妥昔单抗姑息治疗。
在3个时间节点采集外周血样本:术前2天(pre-op)、术后10天(post-op)、末次化疗最后一天(post-chemo)。NGS panel覆盖14个基因(AKT1,BRAF,CTNNB1,EGFR,ERBB2,FBXW7,GNAS,KRAS,MAP2K1,NRAS,PIK3CA,SMAD4, TP53,APC),包括≥240个热点突变,检测下限为0.1%。
研究结果
患者基线特征及治疗前ctDNA检测
患者基线临床病理学特征及其与ctDNA的关联见表1。22例(44.9%)患者术前ctDNA检出突变,其中20例(90.9%)患者为T3/T4。术前ctDNA阳性与血管及周围神经浸润相关,但与淋巴结浸润无关。术前ctDNA阳性患者中,基线/术后/腹腔积液CEA水平均较高。
表1. 49例结直肠癌患者的临床病理学特征


22名患者检出40个突变,中位ctDNA突变数为1.5(范围为:1-5)。TP53突变发生频率最高(17/49 = 34.7%),其次是APC、KRAS、FBXW7、NRAS、PIK3CA、SMAD4(图1)。TP53突变与较高的T分期、术前和术后CEA水平相关。所有APC突变均为截短突变。APC突变患者T分期、TNM分期、术前CA19-9、术后CEA水平均更高,肠梗阻几率较大。KRAS突变涉及到G12和G13。每个突变的等位基因频率(VAF)不同(中位值:0.94%)。中位VAF总数(VAFsum)为0.74%。VAFsum较高的患者T分期、TNM分期、血管及周围神经浸润几率较高。T分期较高及TP53突变患者中,术前cfDNA水平显著升高(p = 0.045 and p = 0.033, respectively)。
术后复发监测
术后5例(14.3%)患者检出ctDNA突变,根据突变频率依次为:TP53、APC、KRAS、FBXW7、SMAD4(图1)。术后ctDNA阳性患者的血管及周围神经浸润相关(80.0% vs. 13.3%, p = 0.001; 80.0% vs. 6.7%, p < 0.001)。中位VAF、VAFsum分别为2.83%、6.11%。M分期较高、血管及周围神经浸润患者出现术后VAFsum的几率显著升高。

图1. 49例结直肠癌患者的临床病理学特征总结及连续cfDNA监测分析
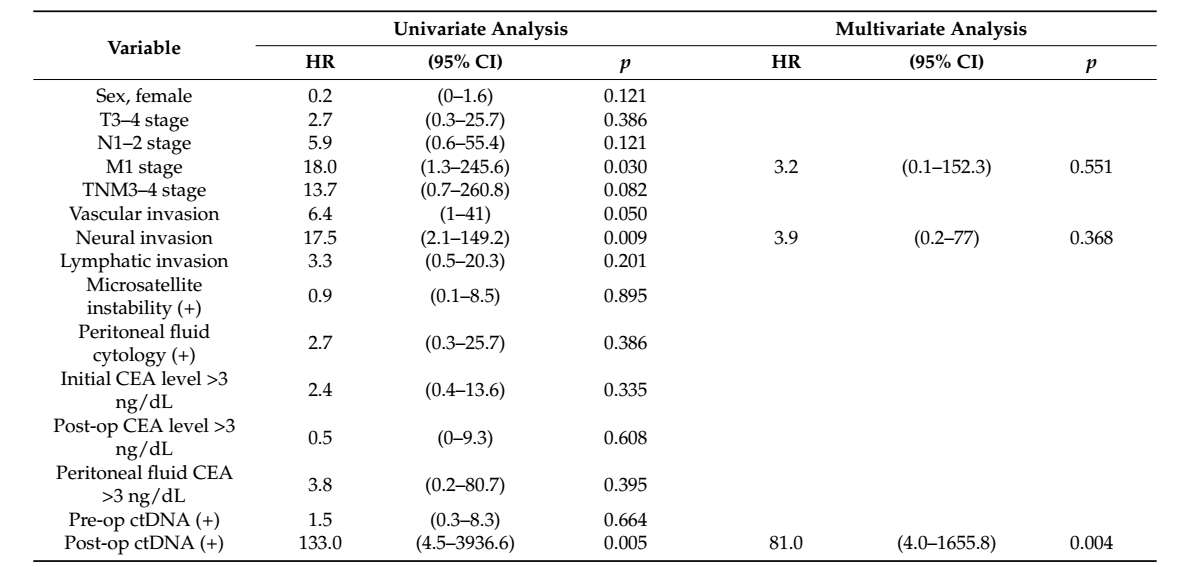
在44例接受R0切除术的患者中,6例(8.8%)在随访过程中出现疾病复发。中位至复发时间为9.9月。较高M分期、周围神经浸润及术后ctDNA状态与疾病复发呈显著相关(p = 0.030, p = 0.009, p = 0.005, respectively)(表2)。在32例可获得术后标本的患者中,术后ctDNA阳性患者的DFS显著缩短(HR = 2.80, 95% CI: 1.68–3.92, p < 0.001)。
31例患者化疗结束后进行了ctDNA检测。2例术后ctDNA阳性患者化疗后ctDNA检测结果为阴性。较高TNM分期及淋巴结浸润阳性患者术后ctDNA阳性几率较高且有统计学意义。
表2. 结直肠癌患者疾病复发的单/多因素回归分析
讨论
本研究利用NGS对CRC患者术前、术后及化疗ctDNA进行检测。约45%患者术前ctDNA检出突变。此外,基线ctDNA阳性患者T分期较高、血管及周围神经浸润几率较高,且外周血及腹腔积液CEA水平较高。与既往研究结果相一致,这些数据表明由于肿瘤坏死及凋亡,肿瘤分期对ctDNA水平有较大影响。周围血管及神经浸润亦与基线ctDNA阳性有关。
ctDNA中不同突变的发生频率与既往研究相仿。TP53基因突变频率最高,之后是APC、KRAS、FBXW7。本研究中,TP53 248、282、175、273号密码子出现突变频率最高,且与血管及神经浸润显著相关,复发患者亦检出这些突变,提示TP53突变肿瘤侵袭性较高。有研究报道34-70%的散发性结直肠癌患者存在APC基因失活突变。本研究也检出9个APC截短突变。在晚期CRC中,确定KRAS突变状态有助于抗EGFR单抗的治疗选择。本研究中FBXW7突变频率为8.2%,既往研究中为10%。FBXW7是一个潜在的肿瘤抑制因子,基因突变可能导致肿瘤进展。既往研究表明FBXW7与CRC患者OS缩短显著相关。基于以上结果可以发现NGS可同时检测多个基因的多种突变,是CRC患者进行ctDNA分析的最有效方法。
约30-50%的CRC患者在R0切除后出现复发,监测残余病灶的最佳方式和时间节点的选择尤为重要。本研究中,发现术后ctDNA突变率下降了14.3%。术后及化疗后ctDNA清零的患者均未出现复发。值得注意的是,3例R0切除患者术后10天ctDNA仍为阳性的患者出现复发。未接受R0切除的患者术后ctDNA仍为持续阳性提示有肿瘤残留。因此,术后ctDNA水平可作为划分复发风险的依据,可辅助选择后续治疗方案。
本研究为真实世界研究,存在一定局限性。例如化疗后的ctDNA样本较少、携带特定基因突变的患者较少,单一基因突变对于复发的影响及治疗疗效的影响未知、随访期较短等。需行进一步行大规模研究明确术后及化疗后ctDNA阳性的发生率及其临床意义。
点评
本研究为前瞻性研究,探索了利用NGS连续监测ctDNA动态变化的可行性及与CRC复发之间的关系。结果证实NGS在CRC患者中进行ctDNA分析是合适的方法术后或辅助化疗后ctDNA阳性,尤其是R0切除的ctDNA阳性患者在随访过程中均出现复发,提示术后和辅助化疗后的ctDNA状态可作为预测复发高风险个体的潜在标志物。同时,检测结果提示TP53、APC和KRAS等基因突变的频率较高,且对于肿瘤患者的治疗和预后具有重要意义,提示利用NGS对多种基因多种突变进行检测的必要性。利用血液样本检测ctDNA,预测CRC术后复发风险具有潜在的临床应用价值,有助于CRC术后风险管理,为高危个体提供了持续动态监测可最大限度缩短治疗失败的等待时间,为制定个体化治疗策略,延长结直肠癌患者的生存期提供了新的机遇。
参考文献:
Postoperative Circulating Tumor DNA Can Predict High Risk Patients with Colorectal Cancer Based on Next-Generation Sequencing. Cancers. 2021 Aug 20.






