近日,求臻医学助力北京大学肿瘤医院李忠武教授团队完成针对直肠黏膜黑色素瘤(RMM)基因图谱的初步探索。这是专注于中国 RMM 患者队列的体细胞突变的研究,为RMM靶向治疗带来新希望。本研究使用求臻医学ChosenOne™500大Panel检测产品,针对RMM肿瘤样本进行精准检测、评估多种突变类型、依赖多个基因组位点组合分析肿瘤标志物TMB和MSI,探索RMM潜在治疗靶点。

研究背景
RMM是一种非常罕见且侵袭性极强的恶性黑色素瘤,预后较差。由于 RMM 的稀有性,发病率约占全部恶性黑色素瘤的0.4%~1.6%,既往少有研究关注其分子特征,特别是在中国人群中。本项回顾性研究,旨在分析中国RMM的突变图谱和预后风险因素,为RMM靶向治疗奠定基础。
研究方法
北京大学肿瘤医院李忠武教授多年来专注于恶性黑色素瘤病理诊断及其分子机制研究。本研究选取其团队提供的北京大学肿瘤医院36 例原发性 RMM 患者,通过对这些肿瘤样本进行ChosenOne™500大Panel检测,检测基因组变异,进一步采用单变量和多变量 Cox 风险分析,以评估基因变异与总生存期(OS)的相关性,使用Kaplan-Meier生存分析中log-rank检验判断其显著性。
研究结果
通过对36例中国RMM患者肿瘤样本进行NGS大Panel检测,体细胞突变分析结果见图1。 在本项中国RMM队列中,KIT(33%)、PDGFRA(25%)和MYC(25%)是人群突变频率最高的3个基因。此外,多个样本发生BRAF突变的位点不同,包括 p.V600E、p.D594G、p.G469A和p.R146Q。

图1.RMM患者基因突变图谱
2.识别预后相关的突变特征
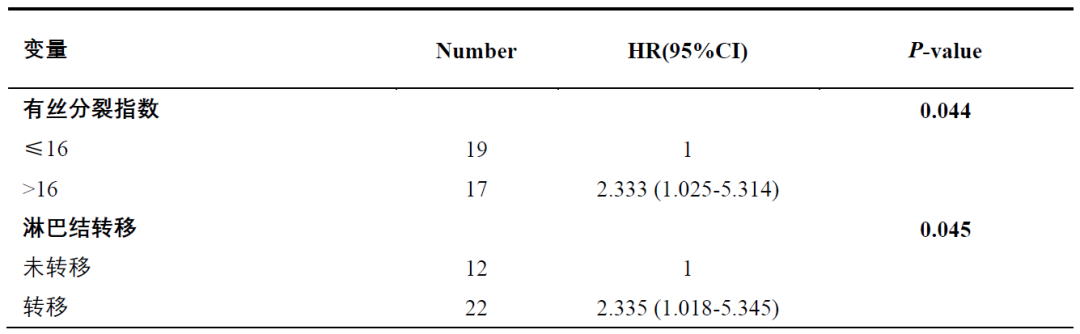
我们在中国RMM患者队列中,使用单变量及多变量Cox回归分析方法分析临床病理特征及总生存之间的相关关系。结果发现,有丝分裂指数和淋巴结转移与总生存之前存在显著关联(P = 0.044和P = 0.045)(表1)。
表1 单变量分析评估 OS 相关的临床病理特征
进一步评估基因变异与总生存的关系发现,具有BRAF突变的RMM患者的生存期明显短于BRAF野生型患者(P=0.008)(图2 A)。另外,NGFR拷贝数缺失与总生存之间存在显著关联(P=0.001)(图2 B)。
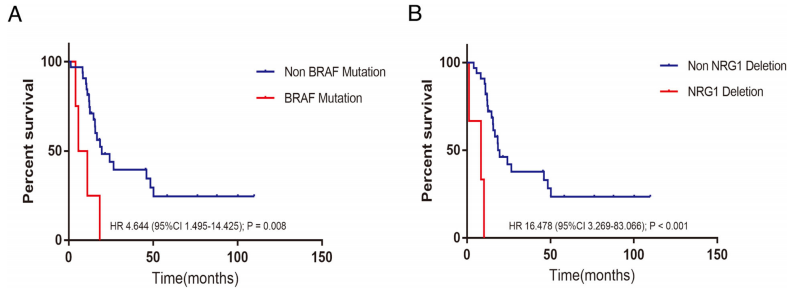
图2.RMM患者预后分子特征识别
研究小结
专家介绍
北京大学肿瘤医院
病理科 副主任
李忠武 教授
主任医师、硕士研究生导师
CSCO 黑色素瘤青年委员会副主任委员
北京抗癌协会青年理事会理事
中国抗癌协会胰腺癌专业委员会神经内分泌肿瘤学组委员
世界华人消化杂志编委
肿瘤学年鉴(Annals of Oncology)消化道肿瘤中文版编委
BMC Cancer 、中华肿瘤学、中华病理学等杂志审稿人
中华医学会病理学消化疾病学组委员
李忠武教授重点从事胃肠道肿瘤及黑色素瘤病理诊断及其分子机制研究。2015—2016年,美国加州大学旧金山分校(UCSF)访问学者。先后获得北京市科技新星,人社部留学归国人员择优资助项目等省部级课题6项。以第一作者和通讯作者发表SCI文章30余篇。
ChosenOne™500
ChosenOne™500是新一代测序(NGS)多基因大Panel检测产品,可以在自动化工作流中一次性分析DNA及RNA水平的523个与肿瘤密切相关基因的状态,并可精准检测、评估多种变异类型,包括单核苷酸变异、插入缺失、剪接变异、已知与未知融合及依赖多个基因组位点组合分析的TMB和MSI。严谨的生物信息流程结合独特的双端UMI设计可进行高准确度的变异检测。

参考文献:
1. Chang AE, Karnell LH, Menck HR. The National Cancer Data Base report on cutaneous and noncutaneous melanoma: a summary of 84,836 cases from the past decade. Cancer. 1998;83(8):1664–78. https://doi.org/10.1002/(SICI)10970142(19981015)83:8<1664::aid-cncr23>3.0.CO;2-G.
2. Chi Z, Li S, Sheng X, Si L, Cui C, Han M, et al. Clinical presentation, histology,and prognoses of malignant melanoma in ethnic Chinese: a study of 522 consecutive cases. BMC Cancer. 2011;11(1):85. https://doi.org/10.1186/1471-2407-11-85.
3. Hillenbrand A, Barth TF, Henne-Bruns D, Formentini A. Anorectal amelanotic melanoma. Color Dis. 2008;10(6):612–5. https://doi.org/10.1111/j.1463-1318.2007.01400.x.
4. Coté TR, Sobin LH. Primary melanomas of the esophagus and anorectum:epidemiologic comparison with melanoma of the skin. Melanoma Res.2009;19(1):58–60. https://doi.org/10.1097/CMR.0b013e32831ef262.
5. Cui C, Tang B, Guo J. Chemotherapy, biochemotherapy and anti-VEGF therapy in metastatic mucosal melanoma. Chin Clin Oncol. 2014;3(3):36.
https://doi.org/10.3978/j.issn.2304-3865.2014.07.02.
6. Dumaz N, Jouenne F, Delyon J, Mourah S, Bensussan A, Lebbe C. Atypical BRAF and NRAS mutations in mucosal melanoma. Cancers (Basel). 2019;
11(18):1133. https://doi.org/10.3390/cancers11081133.







